
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)已知:①N2(g)+O2(g)2NO(g) ΔH=+180.5 kJ/mol;
②CO的燃烧热为283.0 kJ/mol。
则2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH=________kJ/mol。
(2)在恒温、恒容条件下,将2.0 mol NO和1.0 mol CO充入一个容积为2 L的密闭容器中发生上述反应,反应过程中部分物质的物质的量(n)变化如图所示。
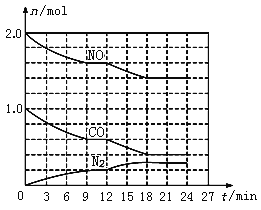
①N2在0~9 min内的平均反应速率v(N2)=________mol/(Lmin);
②第9 min时氮气的产率为________;
③第12 min时改变的反应条件可能为_______(填字母代号);
A.升高温度 B.加入NO C.加催化剂 D.减小压强 E.降低温度
④若在第24min将NO与N2的浓度同时增加到原来的2倍,化学平衡______移动(填“向正反应方向”、“逆反应方向”或“不”)。
(3)若将反应容器改为恒温容积可变的恒压密闭容器,压强为P=3.0MPa,反应物加入的物质的量不变,达到平衡时CO的转化率为50%,该温度下此反应平衡常数Kp=______
【答案】-746.5 0.011 40% E 向正反应方向 0.10Mpa-1
【解析】
(1)已知①N2(g)+O2(g)2NO(g) ΔH=+180.5 kJ/mol,又知CO的燃烧热为283.0kJ/mol,可得热化学方程式:②CO(g)+![]() O2(g)=CO2(g) ΔH=283.0kJ/mol,根据盖斯定律,②×2①可得:2NO(g)+2CO(g)N2 (g)+2CO2 (g),据此计算出该反应的焓变;
O2(g)=CO2(g) ΔH=283.0kJ/mol,根据盖斯定律,②×2①可得:2NO(g)+2CO(g)N2 (g)+2CO2 (g),据此计算出该反应的焓变;
(2)①根据v=![]() 计算在09min内N2的平均反应速率v(N2);
计算在09min内N2的平均反应速率v(N2);
②根据产率=![]() 进行计算;
进行计算;
③12min时改变条件瞬间氮气浓度增大,NO、CO浓度减小,则平衡向正反应方向移动,结合温度、压强、浓度、催化剂对平衡的影响分析解答;
④根据混合体系中生成物浓度幂之积/反应物浓度幂之积和化学平衡常数的相对大小进行判断;
(3)利用三段式算出平衡后每种物质的物质的量,Kp为生成物平衡分压幂之积除以反应物平衡分压幂之积。
(1)已知①N2(g)+O2(g)2NO(g) ΔH=+180.5 kJ/mol,又知CO的燃烧热为283.0kJ/mol,可得热化学方程式:②CO(g)+![]() O2(g)=CO2(g) ΔH=283.0kJ/mol,根据盖斯定律,②×2①可得:2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH=746.5kJ/mol,故答案为:746.5;
O2(g)=CO2(g) ΔH=283.0kJ/mol,根据盖斯定律,②×2①可得:2NO(g)+2CO(g)N2 (g)+2CO2 (g) ΔH=746.5kJ/mol,故答案为:746.5;
(2)①09min内N2浓度变化为:![]() =0.1mol/L,则N2在09min内的平均反应速率为:v(N2)=
=0.1mol/L,则N2在09min内的平均反应速率为:v(N2)=![]() =0.011molL1min1;
=0.011molL1min1;
②由图像可知,9min时n(N2)=0.2mol,根据反应方程式可知,N2理论产量为0.5mol,则产率为![]() =40%;
=40%;
③由图可知,反应2NO(g)+2CO(g)N2 (g)+2CO2 (g)中氮气浓度增大,NO、CO浓度减小,则平衡向正反应方向移动;
A.该反应为放热反应,升高温度,平衡逆向移动,与图像不符,故A错误;
B.加入NO,则n(NO)增大,与图象不相符,故B错误;
C.加催化剂,平衡不发生移动,各物质的浓度不变,故C错误;
D.反应正向是体积减小的反应,减小压强,则平衡逆向移动,NO、CO浓度增大,N2浓度减小,故D错误;
E.该反应为放热反应,降低温度,平衡正向移动,与图像相符,故E正确;
④由图可知,第24min时,n(NO)=1.4mol,n(CO)=0.4mol,n(N2)=0.3mol,根据化学方程式可知n(CO2)=0.6mol,则反应的平衡常数为: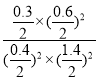 =0.69,将NO与N2的浓度同时增加到原来的2倍,则n(NO)=2.8mol,n(N2)=0.6mol,则
=0.69,将NO与N2的浓度同时增加到原来的2倍,则n(NO)=2.8mol,n(N2)=0.6mol,则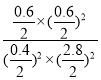 =0.34<0.69,所以平衡向正反应方向移动;
=0.34<0.69,所以平衡向正反应方向移动;
(3)由CO的转化率为50%,可得:
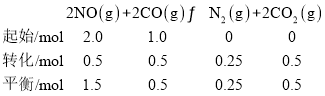
则该温度下此反应平衡常数Kp=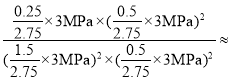 0.10MPa-1。
0.10MPa-1。


科目:高中化学 来源: 题型:
【题目】溴乙烷是卤代烃的代表,通过对溴乙烷的探究来掌握卤代烃的性质,可以达到举一反三、触类旁通的效果。
I.已知:NaBr+H2SO4(浓) ![]() NaHSO4+ HBr
NaHSO4+ HBr
CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
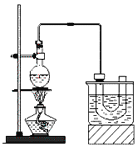
溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是_______________。
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:______(填序号)
A.NaOH溶液 B.H2O
C.Na2SO3溶液 D.CCl4
分离时所需的主要玻璃仪器是______________(填仪器名称)。要进一步制得纯净的溴乙烷,可用水洗,然后加入无水CaCl2,再进行_________(填操作名称)。
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
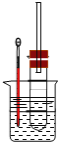
(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。试管口安装一长导管的作用是_________。
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式_____________________________________________。
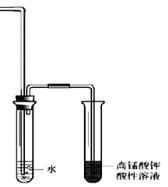
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是___________,检验的装置如图所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
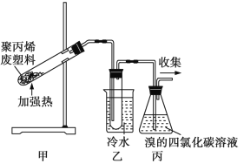
A.装置乙试管中收集到的液体在催化剂存在下可以与Br2发生取代反应
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.最后收集的气体可以作为清洁燃料使用
D.甲烷的二氯代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中E表示分子平均能量,Ec是活化分子具有的最低能量。下列说法不正确的是( )
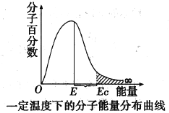
A.图中Ec与E之差表示活化能
B.升高温度,图中阴影部分面积会增大
C.使用合适的催化剂,E不变,Ec变小
D.能量大于Ec的分子间发生的碰撞一定是有效碰撞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
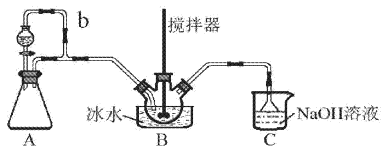
(1)装置A制取SO2
①A中反应的化学方程式为___。
②导管b的作用是___。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___(只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___。
(3)装置C的主要作用是___(用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+__C2O42-+__=__Mn2++__+__H2O
②滴定终点时的现象为___。
③亚硝酰硫酸的纯度=___。(精确到0.1%)[M(NOSO4H)=127g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锌锰电池含有锌、锰元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用废旧锌锰电池回收锌和制备二氧化锰、硫酸的工艺流程如图:
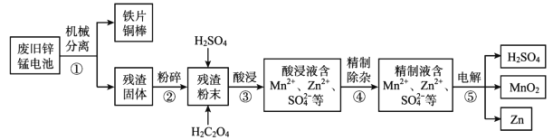
回答下列问题:
(1)步骤②“粉碎”的主要目的是______。
(2)步骤③“酸浸”发生了一系列反应:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推测 Mn2O3 与硫酸反应的离子方程式为______。
(3)如图分别表示“酸浸”时选用不同浓度硫酸和草酸对 Zn、Mn 浸出率的影响。
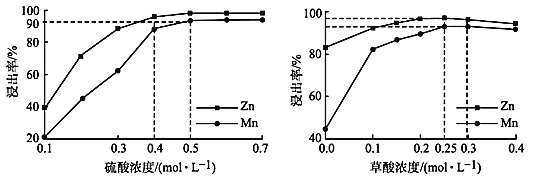
①为保证 Zn、Mn 的浸出率均大于 90%,步骤③需控制的 c(H2SO4) = ____mol/L。H2C2O4 浓度对 Mn 的浸出率影响程度大于 Zn,其原因是_____。
②假设“酸浸”所得溶液中Zn2+、Mn2+浓度相等。当 c(H2C2O4)>0.25 mol/L 时,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序号)。
a.随着反应进行 c(H+)降低
b.Zn2+、Mn2+与 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步骤⑤用惰性电极电解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 还可能生成 H2、O2 或其混合物。
①生成 MnO2 的电极反应式为_____ 。
②若 n (H2) :n (O2)=2:1,则参加反应的 n (Zn2+):n (Mn2+) = ______。
③该工艺流程中可循环利用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内反应的平均反应速率为__;
(2)10s末,生成物D的浓度为__;
(3)若改变下列条件,生成D的速率如何变化(用“增大”“减小”或“不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | ___ |
② | 增大A的浓度 | ___ |
③ | 使用正催化剂 | ___ |
④ | 恒容下充入Ne (不参与体系反应) | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的容器中,用纯净的CaCO3与100mL稀盐酸反应制取CO2,反应生成CO2的体积随时间的变化关系如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )

A.OE段表示的平均反应速率最快
B.F点收集到的CO2的量最多
C.EF段,用盐酸表示该反应的平均反应速率为0.4mol·L-1·min-1
D.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com