


科目:高中化学 来源: 题型:
| A、煤炭经气化、液化和干馏等过程,可以转化为清洁能 |
| B、利用二氧化碳制造全降解塑料,可以缓解温室效应 |
| C、利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
| D、高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol H2O的质量为18 g/mol |
| B、CH4的摩尔质量为16 g |
| C、3.01×1023个SO2分子的质量为32 g |
| D、2mol NaOH溶于1 L水中配成溶液的浓度为2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNH4+中含质子数为11NA |
| B、1molOH-中含电子数为10NA |
| C、1molNa+中含电子数为10NA |
| D、1molF-含有的质子数与电子数之和为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HD、NaOH都属于化合物 |
| B、碳素钢、不锈钢和目前流通的硬币都属于合金 |
| C、浓盐酸、浓硫酸、浓硝酸都属于氧化性酸 |
| D、氨水、醋酸、氢氧化铝都属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑥⑦⑧ | B、①④⑤⑦ |
| C、②⑤⑦⑧ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
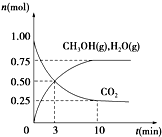 (1)科学家用H2和CO2生产甲醇燃料.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.
(1)科学家用H2和CO2生产甲醇燃料.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com