
| A、②⑥⑦⑧ | B、①④⑤⑦ |
| C、②⑤⑦⑧ | D、①③④⑥ |
| 22.4L |
| 22.4L/mol |
| 22.4L |
| 22.4L/mol |
| 1mol |
| 0.5L |
| 4mol-2mol |
| 0.5L |
| 4mol-2mol |
| 0.5L |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
| A、②③④ | B、①⑥⑦ |
| C、①③⑤ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
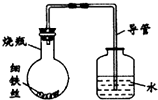 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.| 时间/小时 | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
| A瓶(盛干燥铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| B瓶(盛沾了食盐水的铁丝) | 0 | 0.4 | 1.2 | 3.4 | 5.6 | 7.6 | 9.8 |
| C瓶(盛沾了清水的铁丝) | 0 | 0 | 0 | 0.3 | 0.8 | 2.0 | 3.5 |
| D瓶(盛完全浸没在食盐水中的铁丝) | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅具有半导体性质,可用于生产光导纤维 |
| B、H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、二氧化硫具有漂白性,铵不可用于食品漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35.5aV2=W2-W1 | ||
| B、23n(Na)+27n(Al)=W1 | ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
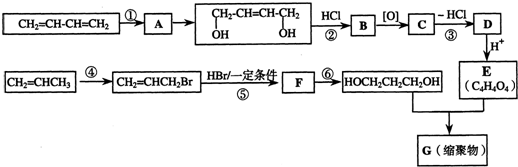
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com