
| A、35.5aV2=W2-W1 | ||
| B、23n(Na)+27n(Al)=W1 | ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
| ||
| ||
| 3 |
| 2 |
| V1L |
| 22.4L/mol |
| V1 |
| 22.4 |
| V1 |
| 11.2 |
| V1 |
| 11.2 |
| V1 |
| 11.2 |
| V1 |
| 11.2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②⑥⑦⑧ | B、①④⑤⑦ |
| C、②⑤⑦⑧ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 | 固体全部溶解则没有S生成 |
| 步骤2:取少许液体加HCl | |
| 步骤3 取少许液体加HCl和BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
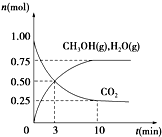 (1)科学家用H2和CO2生产甲醇燃料.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.
(1)科学家用H2和CO2生产甲醇燃料.为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com