

| ||
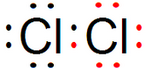 ,氯气具有强氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以可以用湿润的淀粉碘化钾试纸检验生成气体,故答案为:2H++2e-=H2↑;
,氯气具有强氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以可以用湿润的淀粉碘化钾试纸检验生成气体,故答案为:2H++2e-=H2↑;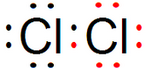 ;将湿润的淀粉碘化钾试纸靠近a管口,若变蓝,说明生成了氯气;
;将湿润的淀粉碘化钾试纸靠近a管口,若变蓝,说明生成了氯气;| 2.16g |
| 108g/mol |
| 22.4L×0.02mol |
| 8mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅具有半导体性质,可用于生产光导纤维 |
| B、H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、二氧化硫具有漂白性,铵不可用于食品漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35.5aV2=W2-W1 | ||
| B、23n(Na)+27n(Al)=W1 | ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
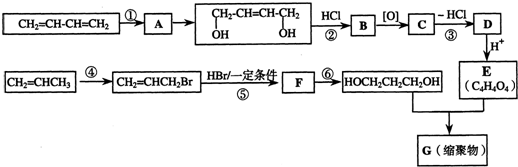
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 溶度积常数 | 化学式 | 溶度积常数 |
| Ag2S | 6.3×10-50 | AgCl | 1.8×10-10 |
| CuS | 4.3×10-36 | AgBr | 5.4×10-13 |
| FeS | 6.3×10-18 | AgI | 8.3×10-17 |
| A、除去工业废水中的Cu2+可以选用Na2S作沉淀剂 |
| B、将AgCl、AgBr和AgI饱和溶液等体积混合后,再加入足量的浓AgNO3溶液,首先析出AgI沉淀 |
| C、Ag2S、CuS、FeS溶解度依次增大 |
| D、将FeS加入较浓的CuSO4溶液中,会有CuS生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下22.4L H2O中含有氢原子的个数为2NA |
| B、2.7g 铝与足量的盐酸反应时失去的电子数为0.3NA |
| C、1mol/L NaCl溶液中含有钠离子的个数为NA |
| D、常温常压下,11.2 L氧气含有的原子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com