
| 相对分子量 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 26 | 161 | 微溶于水 |
| 环己酮 | 0.8102 | 0.8102 | -45 | 155.6 | 微溶于水 |
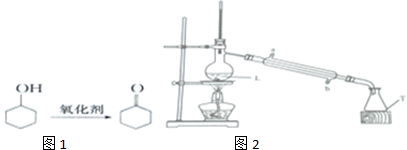
分析 (1)环己醇在重铬酸钾溶液中被氧化成环己酮,重铬酸钾溶液较多时也可氧化成己二酸;根据实验温度控制在55~60℃,确定加热方式;
(2)环己酮微溶于水,所以在水溶液中有少量的环己酮;
(3)烧杯口较大,部分环己酮能挥发;生石灰能与副产物己二酸、水等反应,使这些物质不能被蒸馏出来,而氯化钙不能与己二酸反应,吸收的水在加热时也容易失去,温度计水银球高于支管口,蒸出的物质沸点偏高,蒸出的物质会增多,据此答题;
(4)为减少产物的损失,应先通冷凝水再加热,逆流冷却效果好,碎瓷片可以防止瀑沸;
(5)根据己二酸能使碳酸氢钠溶液产生气泡,检验己二酸的存在;
(6)根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)环己醇在重铬酸钾溶液中被氧化成环己酮,重铬酸钾溶液较多时也可氧化成己二酸,所以重铬酸钾要分批加入;根据实验温度控制在55~60℃,所以可以用水浴的加热方式,
故答案为:减少副产物生成;水浴加热;
(2)环己酮微溶于水,所以在水溶液中有少量的环己酮,用乙醚萃取水溶液中有机物,可以减少产品损失,
故答案为:减少产品损失;
(3)烧杯口较大,部分环己酮能挥发,产率可能会偏低;生石灰能与副产物己二酸、水等反应,使这些物质不能被蒸馏出来,而氯化钙不能与己二酸反应,吸收的水在加热时也容易失去,所以如果用氯化钙替代生石灰,产率可能会偏高,温度计水银球高于支管口,蒸出的物质沸点偏高,蒸出的物质会增多,产率可能会偏高,
故答案为:偏低;偏高;偏高;
(4)为减少产物的损失,应先通冷凝水再加热,逆流冷却效果好,所以冷凝管中进水口是b,碎瓷片可以防止液体瀑沸,
故答案为:B; A;b; 防液体暴沸;
(5)根据己二酸能使碳酸氢钠溶液产生气泡,检验己二酸的存在,实验方案为取产品于试管,加入蒸馏水,再加入碳酸氢钠溶液,弱产生气泡,则含有己二酸.否则,不含己二酸,
故答案为:取产品于试管,加入蒸馏水,再加入碳酸氢钠溶液,弱产生气泡,则含有己二酸.否则,不含己二酸;
(6)10.0g环己醇的物质的量为$\frac{10.0}{100}$mol=0.1mol,生成的环己酮的物质的量为0.1mol,其质量为0.1×98g=9.8g,所以环己酮的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{6.5g}{9.8g}$×100%=66.3%,故选B.
点评 本题考查有机实验制备,涉及对装置与操作的分析评价、物质的分离提纯、产率计算等,难度中等,是对学生综合能力的考查.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的N0和CO | B. | 等物质的量的CO和N2 | ||
| C. | 等物质的量的C02和C0 | D. | 等物质的量的Mg和Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{500a}{23V}$mol/L | B. | $\frac{142a}{46V}$mol/L | C. | $\frac{142a}{23V}$mol/L | D. | $\frac{1000a}{23V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g CO和16g O2所含的原子数都为2NA | |
| B. | 300mL 2mol/L乙醇水溶液中所含H原子数为3.6NA | |
| C. | 标准状况下,22.4L CO2和O2的混合气体含有的分子总数为NA | |
| D. | 5.6g Fe与足量Cl2反应时转移电子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H2 | C. | C2H4 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17g羟基(-OH)所含有的电子数是NA | |
| B. | 常温常压下,4g氮气所含有的原子数目为NA | |
| C. | 1 L 0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| D. | 标准状况下,22.4L乙醇的分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com