
| ||
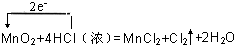 ,由反应可知,转移2mol电子生成1molCl2,则电子转移的数目为3.01×1023个时,生成氯气为0.5mol×
,由反应可知,转移2mol电子生成1molCl2,则电子转移的数目为3.01×1023个时,生成氯气为0.5mol×| 1 |
| 2 |
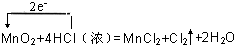 ;5.6.
;5.6.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1.0L 1.0mol?L-1的NaAlO2溶液中含有的氧原子数为2NA |
| B、标准情况下,22.4L SO3中的原子总数为4NA |
| C、3.01×1023个一氧化碳分子所占体积是11.2L |
| D、25.5g NH3在标准状况下所占的体积为33.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| B、在常温常压下,将0.5mol 硫放中足量氧气中充分反应生成SO2(g),放热148kJ,其热化学方程式为:S(s)+O2(g)═SO2(g)△H=+296kJ?mol-1 |
| C、氧化铝溶于NaOH溶液:Al2O3+OH-+H2O═Al(OH)3 |
| D、氯化镁溶液与氢氧化钾溶液反应:Mg2++2OH-=Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 置换反应的通式可表示为如图:单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可表示为如图:单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com