
【题目】下列物质中,不能电离出酸根离子的是( )
A.Na2OB.KMnO4C.NH4NO3D.CaCl2
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中不正确的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应将温度计水银球放在被加热的混合液中
C.过滤时,需要用玻璃棒引流
D.使用分液漏斗分液前要先检漏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实得出的相应结论不正确的是
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 向2.0 mL浓度均为0.1 mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
C | 2NO2(g) | 加压平衡向着气体颜色加深的方向移动 |
D | 将MgCl2溶液蒸干后灼烧,得到MgO固体 | 蒸干的过程中水解生成的HCl挥发,水解进一步促进生成Mg(OH)2,灼烧后产生MgO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1mol/LpH为4的NaHB溶液中:c (HB-)>c(H2B)>c(B2-)
B. 如图表示25℃时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液时,溶液的pH随加入酸体积的变化

C. 在pH=2的NaHSO4溶液中c(H+)=c(OH-)+ c(SO42-)
D. pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示,分别滴加NaOH溶液(c=0.1mol·L-1)至pH=3,消耗NaOH溶液的体积为Vx、Vy,则x为强酸,y为弱酸且Vx>Vy

查看答案和解析>>
科目:高中化学 来源: 题型:
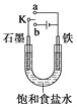
【题目】(1)某课外活动小组同学用左图装置进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的________腐蚀。
②若开始时开关K与b连接,则总反应的离子方程式为
_____________________________________________________________________。
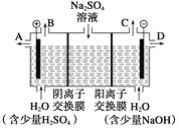
(2)芒硝化学式为Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用右图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念。
①该电解槽的阳极反应式为__________________。此时通过阴离子交换膜的离子数__________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钠溶液从出口(填“A”,“B”,“C”或“D”)________导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因:_____________________________________________。
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为____________。已知H2的燃烧热为285.8 kJ·mol-1,则该燃料电池工作产生36 g液态H2O时,理论上有________ kJ的能量转化为电能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组研究二价铁的还原性,设计如下实验。
序号 | 实验方案 | 现象 |
Ⅰ |
| 现象a:生成白色沉淀,3 min后沉淀基本变为红褐色 |
Ⅱ |
| 现象b:生成白色沉淀,3 min后沉淀颜色几乎不变 |
(1)实验所用的FeSO4溶液由Fe2(SO4)3溶液和足量铁粉反应制得,离子方程式是____。
(2)实验I中沉淀变为红褐色的化学方程式是________。
(3)关于实验II中白色沉淀的组成,小组同学展开研究。
① 已知Fe(HCO3)2在水中不存在。对沉淀组成作出如下假设,请补充完整。
假设a:依据NaHCO3溶液显_______性,推测白色沉淀可能为Fe(OH)2;
假设b:白色沉淀可能为_______。
② 研究白色沉淀组成的实验如下:
i.取少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量H2O2,溶液立即变为红色。
由此说明,白色沉淀中一定含有_________离子。
③ 研究过程中发现白色沉淀在空气中久置,最终变为红褐色。则该沉淀比实验I中所得的Fe(OH)2______(填“难”或“易”)于被空气氧化。
(4)对比实验I,研究酸碱性对二价铁还原性的影响,设计实验III:
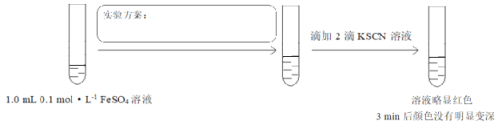
将实验方案补充完整______。
(5)据以上实验,为避免二价铁被空气氧化,可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com