
����Ŀ����Ҫ��ش��������⡣
��1��KMnO4��Ϊǿ��������������������Һ��������ǿ�����������Խ����л�ԭ������Mn2+,�����Ի���Խ����л�ԭ������Ҫ��MnO2,��д��KMnO4�����������½�H2O2���������ӷ���ʽ:___________________��
��2����������(Na2FeO4) ��ˮ���������е�һ�����;�ˮ������ҵ������NaClO��NaOH�Ļ����Һ��Fe(OH)3�����Ʊ���������,��Ӧ�Ļ�ѧ����ʽΪ________________��
��3�����ʯ(TiO2)��̿�ۻ�ϣ��ڸ���������,ͨ��Cl2�Ƶ�TiCl4��һ�ֿ�ȼ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
��4��H3PO3�Ĺ�ҵ�Ʒ��ǽ�����(P4)��Ba(OH)2��Һ��Ӧ����PH3�����Ba(H2PO2)����������H2SO4��Ӧ��д��������Ba(OH)2��Һ��Ӧ�Ļ�ѧ����ʽ:_________��
���𰸡� 2MnO4����5H2O2��6H����2Mn2����5O2����8H2O 3NaClO + 4NaOH+ 2Fe(OH)3= 2Na2FeO4 + 3NaCl + 5H2O TiO2+2C+2Cl2 ![]() TiCl4+2CO 2P4��3Ba(OH)2��6H2O��3Ba(H2PO2)2��2PH3��
TiCl4+2CO 2P4��3Ba(OH)2��6H2O��3Ba(H2PO2)2��2PH3��
��������(1)KMnO4�����������½�H2O2��������ԭ������Mn2+��H2O2������������O2��ͬʱ��Ӧ������ˮ�����ݵ�ʧ�����غ㷴Ӧ�����ӷ���ʽΪ2MnO4-+5H2O2+6H+ =2Mn2++8H2O+5O2�����ʴ�Ϊ��2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2����
(2)NaClO��NaOH�Ļ����Һ��Fe(OH)3�����õ��������ƣ�������Ӧ�Ļ�ѧ����ʽΪ2Fe(OH)3+3NaClO+4NaOH�T2Na2FeO4+3NaCl+5H2O���ʴ�Ϊ��2Fe(OH)3+3NaClO+ 4NaOH �T2Na2FeO4+3NaCl+5H2O��
(3)�ڸ���ʱ�������ʯ(TiO2)��̿�ۻ�ϲ�ͨ�������Ƶ�TiCl4��һ�ֿ�ȼ���壬����Ԫ���غ㼰ԭ���غ�֪����������CO�����Է�Ӧ����ʽΪ��TiO2+2C+2Cl2![]() TiCl4+2CO���ʴ�Ϊ��TiO2+2C+2Cl2
TiCl4+2CO���ʴ�Ϊ��TiO2+2C+2Cl2![]() TiCl4+2CO��
TiCl4+2CO��
(4)����(P4)��Ba(OH)2��Һ��Ӧ����PH3�����Ba(H2PO2)2����Ӧ����ʽΪ2P4+3Ba(OH)2 +6H2O=3Ba(H2PO2)2+2PH3�����ʴ�Ϊ��2P4+3Ba(OH)2+6H2O =3Ba(H2PO2)2+2PH3����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�̸ɵ�������еĹ���������ڷ�������뻷���н��������Σ�����ԷϾɵ�ؽ�����Դ�������Ե÷dz���Ҫ��ij��ѧ��ȤС����������´����������շϵ���еĸ�����Դ�� 
��1������п�̸ɵ�صĵ����ΪKOH���ܷ�ӦΪZn+2MnO2+2H2O�T2MnOOH+Zn��OH��2 �� �为���ĵ缫��ӦʽΪ
��2���������60����ˮ�ܽ⣬Ŀ���Ǽӿ��ܽ����ʣ�����������¶Ȳ���̫�ߣ���ԭ������
��3������A��������
��4����������Ҫ�ɷ�Ϊ���̻������̻�����м���һ������ϡ���ᡢϡ���ᣬ�����Ͻ�����������Ϊֹ������Ҫ��ӦΪ2MnO��OH��+MnO2+2H2C2O4+3H2SO4�T3MnSO4+4CO2��+6H2O��
�ٵ�1mol MnO2�μӷ�Ӧʱ����mol���ӷ���ת�ƣ�
��MnO��OH����Ũ�����ڼ���������Ҳ�ɷ�����Ӧ����д���䷴Ӧ�Ļ�ѧ����ʽ��
��5��ͭñ�ܽ�ʱ����H2O2��Ŀ�������û�ѧ����ʽ��ʾ����ͭñ�ܽ���ȫ�ɲ���������ȥ��Һ�й�����H2O2 ��
��6��п�̸ɵ�������Ĺ�����KMnO4��Һ���գ��ڲ�ͬpH�£�KMnO4��Һ��Hg�������ʼ���Ҫ������ͼ��ʾ�� 
����ͼ��֪��
��pH��Hg�����ʵ�Ӱ���������
����ǿ���Ի�����Hg�������ʸߵ�ԭ������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25�棬��20mL 0.1molL��1�Ĵ�����Һ�в��ϵ���0.1molL��1��NaOH��Һ����ҺpH�ı仯������ͼ�����й��ڸù�������Һ������Ũ�ȴ�С��ϵ������������ǣ� �� 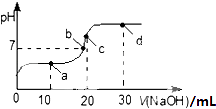
A.a��ʱ��c�� CH3COOH����c�� Na+����c�� CH3COO������c�� H+����c�� OH����
B.b��ʱ��c�� Na+��=c�� CH3COO������c��H+��=c�� OH����
C.c��ʱ��c��OH����=c��CH3COOH��+c��H+��
D.d��ʱ��c��Na+����c��CH3COO������c��OH������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ͼ��ʾװ����ȡ�廯������D��d�о�ʢ��Һ�壬EΪ����¯˿�Ĵɹܣ�e����ֻ���µĴ������й�ʢ��56gϸ���ۣ�ʵ�鿪ʼʱ�Ƚ����������CO2����ͨ��D�У�Ȼ�����ۼ�����600�桫700�棬E���з�Ӧ��ʼ��E�еķ�ӦΪ��
2Fe+3Br2�T2FeBr3 �� 2FeBr3 ![]() 2FeBr2+Br2����
2FeBr2+Br2����
���d��Һ�����100�桫120���D�У�������Сʱ��������Ӧ�������ܵ�һ�˳����л���ɫ��Ƭ״�廯����80g��
��ش�
��1������d������ ��
��2�������CO2���������E�з�������Ӧ���京��������Ϊ�������ò����к��˸�����û�ѧ�������飮���з����������� ��
A��ȡ�����������Թ��м���ϡ���ᣬ�ټ���KSCN��Һ
B��ȡ����������Ӳ�ʴ��Թ��У�ͨ���������ž���������ȣ���CuSO4�������ɵ�ˮ����
C���ô����������������ܷ�����
D��ȡ�����������Թ��м�������ˮ�����˿��Ƿ��к�ɫ������
��3��Ϊ��ֹ��Ⱦ������ʵ��ʱӦ��F������ʢ��NaOH��Һ��β������װ�ã���Ӧ�Ļ�ѧ����ʽ�� ��
��4��ȡ��Ʒ10g���Ƴ�250mL��Һ��ȡ��25.00mL������KMnO4��Һ�ζ���Һ�е�Fe2+ �� ��ȥ0.03000mol/L����KMnO4��Һ25.00mL�����Ʒ�Ĵ���Ϊ ��
��5�����ó�ȥ���ʺ��FeBr2������֤Cl2��Fe3+��Br2��������ǿ����������Ƶ�ʵ�������Ԥ�Ƶ�ʵ�������ʵ����ۣ�������ǿ������д�����б��ո��ڣ�
ʵ����� | ʵ������ | ������ǿ�� |
�� | ��Һ��Ѫ��ɫ | �� |
�� | �� | Cl2��Br2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��������ɫˮ��Һֻ���ܺ������������е�������:K+��NH4+��Fe2+��Cl-��Ca2+��Ba2+��CO32-��SO42-����ȡ����100mL��Һ��������ʵ��:
��һ�ݼ���AgNO3��Һ�г���������
�ڶ��ݼ�������NaOH��Һ���Ⱥ��ռ���0.08mol������
�����ݼ�������BaCl2��Һ�õ��������12.54g,������������ϴ�ӡ������������Ϊ4.66g.
�ۺ�����ʵ�飬�ش���������:
��1�������κ�ʵ��Ϳ��Կ϶�ԭ��Һ�в����ڵ�������__________��
��2���û������һ�����е�����__________�����ܺ��е�����__________��
��3��K+���ʵ���: n(K+)_____(����ֵ��ȡֵ��Χ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ�У���ȷ���ǣ� ��
A.�Ʒ���ˮ��??? Na+H2O�TNa++OH��+H2��
B.��ⱥ��ʳ��ˮ??? 2Cl��+2H2O ![]() 2OH��+H2��+Cl2��
2OH��+H2��+Cl2��
C.ʵ�������Ȼ�����Һ�Ͱ�ˮ����������??? Al3++3OH���TAl��OH��3��
D.��̼�������Һ�м�����������������Һ??? HCO3��+OH���TCO32��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ϊ2L���ܱ������н������з�Ӧ��C��s��+CO2��g���T2CO��g������H=+Q kJmol��1 �� ��ͼΪCO2��CO�����ʵ�����ʱ��t�ı仯��ϵͼ������˵������ȷ���ǣ� �� 
A.��0��1min��CO�����ʵ���������2mol
B.���̽�̿�������������仯ʱ��˵����Ӧ�Ѵ�ƽ��״̬
C.5minʱ�ٳ���һ������CO��n��CO����n��CO2���ı仯�ɷֱ���c��b���߱�ʾ
D.3minʱ�¶���T1���ߵ�T2 �� ����ƽ��ʱK��T2��С��K��T1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� (����)
A. Ħ���DZ�ʾ���ʵ����ĵ�λ,ÿĦ�����ʺ���6.02��1023������
B. 2H�ȿɱ�ʾ2����ԭ��,�ֿɱ�ʾ2 mol��ԭ��
C. ��ͬ���ʵ�����CO��CO2������ԭ������Ŀ֮��Ϊ2��3
D. ��ͬ������CO��CO2������ԭ������Ŀ֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ������ ��
A���������������������ֱ���ȫȼ�գ����߷ų�������
B����C(ʯī)��C(���ʯ) ��H = +1.9 kJ��mol��1��֪ʯī�Ƚ��ʯ�ȶ�
C����ϡ��Һ�У�H++OH�� ![]() H2O ��H =��57.3 kJ��mol��1��������1mol CH3COOH�Ĵ�����Һ�뺬1 mol NaOH����Һ��ϣ��ų�������С��57.3 kJ
H2O ��H =��57.3 kJ��mol��1��������1mol CH3COOH�Ĵ�����Һ�뺬1 mol NaOH����Һ��ϣ��ų�������С��57.3 kJ
D�����Ȼ�ѧ����ʽ�������Ƿ�Ӧ�ﻹ���������������ۼ�״̬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com