
【题目】乙醇能发生如下反应:
①CH3CH2OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
②2Cu+O2![]() 2CuO,CH3CH2OH+CuO
2CuO,CH3CH2OH+CuO![]() CH3CHO+H2O+Cu。
CH3CHO+H2O+Cu。
由以上反应得出的结论错误的是( )
A.由反应①②可知,条件不同,乙醇与O2反应的产物不同
B.由反应②可知,Cu是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键、碳氧键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和 O2(g)反应生成 NO(g)过程中的能量变化,下列正确的是( )
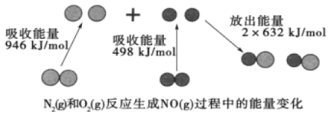
A.1molN2(g) 和 NA 个 O2(g) 反 应 放 出 的 能 量 为 180 kJ
B.1molN2(g)和 1molO2(g)具有总键能小于 2molNO(g)具有的总键能
C.该反应的热化学方程式为:N2(g)+ O2(g)= 2NO(g)△H=+180 kJmol﹣1
D.吸热反应一定需要加热才能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,氨水中NH3·H2O的电离平衡常数:Kb≈1×10-5。向1 L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是
与NH3·H2O的变化趋势如下图所示(溶液体积和温度的变化、氨的挥发均忽略不计),下列说法正确的是

A. NH4Cl的电离方程式为:NH4Cl![]() Cl-+NH4+
Cl-+NH4+
B. M点时,pH≈9
C. a=0.05
D. 当n(NaOH)=0.05 mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式___。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=___kJ·mol-1。
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
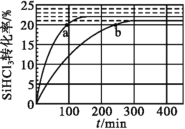
①343K时反应的平衡转化率α=___%。
②比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(CuS)=1.0×10-36,K sp(HgS)=1.6×10-52;pM=-lgc(M2+)。常温下,向10.0mL0.20mol·L-1Cu(NO3)2溶液中逐滴滴加0.10mo l·L-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法错误的是

A. V0=20.0mL,m=18
B. 若c[Cu(NO3)2]=0.01mol·L-1,则反应终点可能为e点
C. a、b、d三点中,由水电离的c(H+)和c(OH-)的积最大的为b点
D. 相同条件下,若用等浓度等体积的Hg(NO3)2溶液代替上述Cu(NO3)2溶液,则反应终点b向c方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3;物质结构与性质]
明朝《天工开物》中有世界上最早的关于炼锌技术的记载,锌也是人体必需的微量元素。回答下列问题:
(1)基态Zn原子核外的最高能层符号是________,基态Zn2+最外层电子排布式为________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除Zn外其余元素的电负性由大到小排序为________。
②向[Zn(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是________。
③已知[Zn(NH3)4]2+的空间构型与![]() 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
④在[Zn(NH3)4]SO4晶体中存在的作用力有________。
A.离子键 B.极性共价键 C.氢键
D.配位键 E.范德华力 F.金属键
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是________________________________。
(4)常温下金属锌晶体的晶胞为六方最密堆积(如图所示),若锌原子的半径为rnm,六棱柱的高为![]() ,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
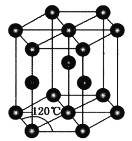
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)向某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g) + xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确的是( )

A.30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08mol/(L·min)
C.反应方程式中的x=1,正反应为吸热反应
D.20min~40min间该反应的平衡常数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是( )
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=+642 kJmol-1
B.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ
C.已知:H2(g)+![]() O2(g)═H2O(l) △H=-286 kJmol-1,则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJmol-1
O2(g)═H2O(l) △H=-286 kJmol-1,则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJmol-1
D.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明醋酸是弱酸的是( )
A.常温下,测得醋酸钠溶液的![]()
B.醋酸可以使紫色石蕊试液变红
C.物质的量浓度相同时,锌粒跟盐酸反应的速率比与醋酸反应的快
D.常温下,测得![]()
![]() 醋酸溶液的
醋酸溶液的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com