
【题目】[化学—选修3;物质结构与性质]
明朝《天工开物》中有世界上最早的关于炼锌技术的记载,锌也是人体必需的微量元素。回答下列问题:
(1)基态Zn原子核外的最高能层符号是________,基态Zn2+最外层电子排布式为________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除Zn外其余元素的电负性由大到小排序为________。
②向[Zn(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是________。
③已知[Zn(NH3)4]2+的空间构型与![]() 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
④在[Zn(NH3)4]SO4晶体中存在的作用力有________。
A.离子键 B.极性共价键 C.氢键
D.配位键 E.范德华力 F.金属键
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是________________________________。
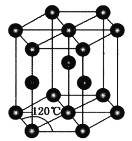
(4)常温下金属锌晶体的晶胞为六方最密堆积(如图所示),若锌原子的半径为rnm,六棱柱的高为![]() ,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
【答案】N 3s23p63d10 O>N>S>H [Zn(NH3)4]2+难电离,溶液中锌离子浓度很小,无法产生沉淀 sp3 氨分子间易形成氢键 ABD 二者同属于离子晶体,O2-的半径比s2-的小,ZnO晶体的晶格能较大 ![]() 或
或![]()
【解析】
(1)Zn是30号元素;基态Zn2+失去最外层两个电子,
(2)①非金属性越强,电负性越强;
②[Zn(NH3)4]2+稳定,在溶液中难电离出Zn2+;
③[Zn(NH3)4]2+空间构型与SO42-相同,为正四面体形,杂化方式相同;
④[Zn(NH3)4]2+与SO42-之间形成离子键,[Zn(NH3)4]2+中Zn2+与NH3之间形成配位键,NH3中、SO42-中原子之间形成极性键;
(3)离子电荷越多、离子半径越小,晶格能越大,离子晶体熔点越高。
(4)空间利用率为晶胞内硬球的总体积占晶胞体积的百分比。
(1)Zn是30号元素,核外电子排布式为1s22s22p62s23p63d104s2;基态Zn2+失去最外层两个电子,
故答案为:N;3s23p63d10
(2)①除Zn外其余元素有N、H、S、O,根据电负性判断方法可知电负性:O>N>S>H,
故答案为:O>N>S>H;
②[Zn(NH3)4]2+稳定,在溶液中难电离出Zn2+,溶液中Zn2+浓度很小,滴加NaOH溶液,无法产生沉淀,
故答案为:[Zn(NH3)4]2+难电离,溶液中锌离子浓度很小,无法产生沉淀;
③[Zn(NH3)4]2+空间构型与SO42-相同,为正四面体形,杂化方式相同,SO42-中心原子价层电子数目=(6+2+0×2)/2=4,杂化方式为sp3杂化,所以Zn2+的杂化类型为sp3杂化;NH3分子间存在氢键,所以易液化
故答案为:sp3;氨分子间易形成氢键;
④[Zn(NH3)4]2+与SO42-之间形成离子键,[Zn(NH3)4]2+中Zn2+与NH3之间形成配位键,NH3中、SO42-中原子之间形成极性键没有非极性键、范德华力、金属键,
故选:ABD;
(3)离子电荷数相同,O2-离子半径比S2-的离子半径小,ZnO晶体的晶格能更大,熔点较高,
故答案为:二者同属于离子晶体,O2-的半径比s2-的小,ZnO晶体的晶格能较大;
(4)底面4个相邻的原子形成的菱形,锐角为60°,Zn原子半径为 rnm,则底面边长为2rnm,底面积=2rnm×2rnm×sin60°=2![]() r2nm2,晶胞的高为
r2nm2,晶胞的高为![]() nm,则晶胞体积=2
nm,则晶胞体积=2![]() r2nm2×
r2nm2×![]() nm=8
nm=8![]() r3nm3,晶胞中Zn原子数目=1+8×1/8=2,Zn原子总体积=
r3nm3,晶胞中Zn原子数目=1+8×1/8=2,Zn原子总体积=![]() 空间利用率=[
空间利用率=[![]() ÷(8
÷(8![]() r3nm3)]×100%=
r3nm3)]×100%=![]() 或
或![]() ;
;
故答案为:![]() 或
或![]() ;
;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如右图所示。下列叙述正确的是
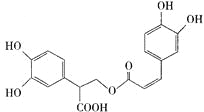
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸可以发生加成、取代、消去、显色反应
C.1mol迷迭香酸跟H2反应,最多消耗8mol H2
D.1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量的A、B气体混合发生反应:xA(g) +yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol·L-1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.20 mol·L-1。下列判断不正确的是
zC(g),平衡时测得A的浓度为0.50mol·L-1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.20 mol·L-1。下列判断不正确的是
A.x+y<zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)常温下,将m mol·L-1的CH3COOH溶液和n mol·L-1NaOH溶液等体积混合后,溶液的pH=7,则m与n的大小关系是m____n(填“>”、“<”或“=”,下同),原酸中c(H+)与碱中c(OH-)的大小关系是c(H+)____c(OH-)。
(2)常温下,将浓度均为0.1mol·L-1的CH3COONa、CH3COOH溶液等体积混合后,溶液呈酸性。则混合溶液中各离子浓度由大到小排序为_____。关于该混合溶液的说法不正确的是___(填代号)。
a.此溶液一定有c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
b.此溶液一定有c(Na+)=c(CH3COOH)+c(CH3COO-)
c.此溶液中水的电离程度一定大于纯水的电离程度
d.向此溶液中加少量氢氧化钠或盐酸,溶液pH变化不大
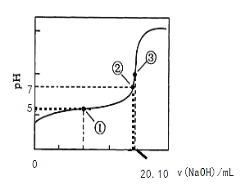
(3)用0.1000 mol·L-1NaOH溶液滴定20.00mL某浓度的CH3COOH溶液,滴定曲线如右图所示。其中点①所示溶液中c(CH3COO-)=1.7c(CH3COOH),点③所示溶液中c(CH3COO-)+c(CH3COOH)=c(Na+)。列式并计算醋酸的电离常数_____,CH3COOH的物质的量浓度为____ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组采用碘量法测定河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2![]() +I2 = 2I+
+I2 = 2I+![]() )。
)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____。
(2)“氧的固定”中发生反应的化学方程式为___________。
(3)Na2S2O3能水解,则滴定时Na2S2O3溶液应装在_____(填下图中的仪器编号)。请补充润洗该仪器的操作方法:从滴定管____加入3~5mL所要盛装的溶液,__________,然后,一手控制活塞(酸式滴定管轻轻转动活塞;碱式滴定管轻轻挤压玻璃球),将液体从滴定管__放入预置的烧杯中。
甲 乙
乙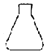 丙
丙![]() 丁
丁![]()
(4)某次滴定前滴定管液面如图所示,读数为________mL。
![]()
(5)量取100.00 mL水样经固氧、酸化后,从中取20.00 mL放入锥形瓶,用a mol·L1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为__mg·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成有机光电材料的原料。H的一种合成路线如图:
已知:R属于芳香族化合物,与新制Cu(OH)2悬浊液共热产生红色固体。请回答下列问题:
(1)R的化学名称是___________;X中官能团的名称是___________。
(2)F→H的反应类型是___________。
(3)E→F的化学方程式为______________。
(4)检验Z中溴元素的试剂有NaOH溶液、AgNO3溶液和___________。
(5)在Y的同分异构体中,同时具备下列条件的同分异构体有________种(不包含立体异构)。
①能发生银镜反应;②遇氯化铁溶液发生显色反应;③能与溴的四氯化碳溶液发生加成反应。
其中核磁共振氢谱有6组峰且峰面积比为1:1:1:1:2:2的结构简式为_________。
(6)参照上述流程,请设计以一溴环已烷和2-丁炔为起始原料制备![]() 的合成路线:__________(无机试剂任选)。
的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2H2(g)+O2(g) ![]() 2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g)
2H2O(l) H= -571.6 kJ·mol-1,2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq)
2CO2(g)+4H2O(l) H= -1452 kJ·mol-1,H+(aq)+OH-(aq) ![]() H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
H2O(l) H= -57.3 kJ·mol-1。据此判断下列说法正确的是
A. CH3OH的燃烧热为1452 kJ·mol-1
B. 2H2(g)+O2(g) ![]() 2H2O(g) H > -571.6 kJ·mol-1
2H2O(g) H > -571.6 kJ·mol-1
C. CH3COOH(aq)+NaOH(aq) ![]() H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
H2O(l)+CH3COONa(aq) H= -57.3 kJ·mol-1
D. 2CH3OH(l)+O2(g) ![]() 2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
2CO2(g)+4H2(g) H= -880.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
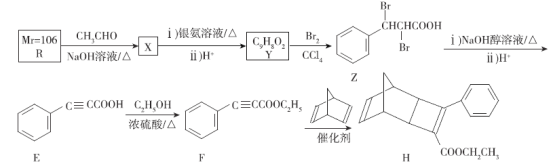
【题目】屠呦呦率领团队先后经历了用水、乙醇、乙醚提取青蒿素的过程,最终确认只有采用低温、乙醚冷浸等方法才能成功提取青蒿素。研究发现青蒿素中的某个基团对热不稳定,该基团还能与NaI作用生成I2 。碳原子连有4个不同的原子或基团时,该碳称为手性碳,下列分析不正确的是
A. 推测青蒿素在乙醚中的溶解度大于在水中的溶解度
B. 青蒿素可以与NaOH、Na2CO3 、NaHCO3反应
C. 青蒿素分子中含有手性碳
D. 青蒿素中对热不稳定且具有氧化性的基团是“-O-O-”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其合金具有密度小,强度高,耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油化工、医药等部门,因此,钛被誉为第三金属和战略金属。从钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:
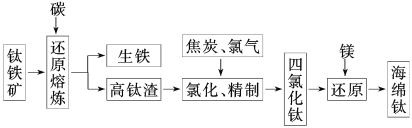
(1)钛铁矿的主要成分是FeTiO3,第一步发生的反应:FeTiO3+C![]() TiO2+Fe+CO↑,在FeTiO3(钛酸亚铁)中,钛的化合价为________。
TiO2+Fe+CO↑,在FeTiO3(钛酸亚铁)中,钛的化合价为________。
(2)第二步:二氧化钛在高温下与焦炭、氯气反应生成四氯化钛和一氧化碳,写出化学方程式:___________,还原产物是____________。
(3)用镁在高温下还原四氯化钛,该反应的环境要求是__________;写出化学方程式:___________。
(4)菱镁矿(主要成分是碳酸镁)煅烧后与焦炭混合在氯化器中高温下通入氯气生成氯化镁,电解熔融氯化镁得到镁。
①写出菱镁矿煅烧及氯化制取氯化镁的化学方程式:______________;
②写出电解熔融氯化镁的电解方程式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com