
【题目】在密闭容器中一定量的A、B气体混合发生反应:xA(g) +yB(g)![]() zC(g),平衡时测得A的浓度为0.50mol·L-1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.20 mol·L-1。下列判断不正确的是
zC(g),平衡时测得A的浓度为0.50mol·L-1。保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.20 mol·L-1。下列判断不正确的是
A.x+y<zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数增大
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的恒容密闭容器中,加人4mol A和2mol B进行反应:3A(g)+2B(g) ![]() 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=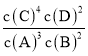
B.此时,B的平衡转化率是20%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是
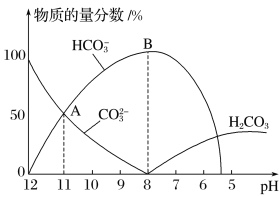
A.溶液的pH为7时,溶液的总体积大于20mL
B.在B点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)
C.在A点所示的溶液中:c(Na+)=c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(CO32-)时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏得到
B.C4H8Cl2的同分异构体有9种(不含立体异构)
C.苯乙烯(![]() )分子中所有原子不可能共平面
)分子中所有原子不可能共平面
D.乙醇和乙酸均能与酸性KMnO4溶液发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,最近有科学家设计了一种在常压下运行的集成BaZrO3基质子陶瓷膜反应器( PCMR) ,将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法正确的是
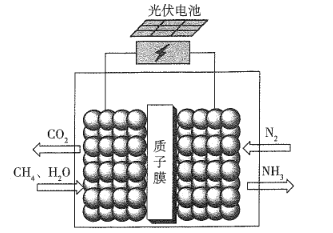
A.阳极的电极反应式为CH4+2H2O+8e-=CO2 +8H+
B.阴极可能发生副反应2H+ +2e- =H2 ↑
C.质子(H+)通过交换膜由阴极区向阳极区移动
D.理论上电路中通过3 mol电子时阴极最多产生22.4 L NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质X2(X表示为Cl、 Br)与H2反应能量转化关系如下,下列说法不正确的是
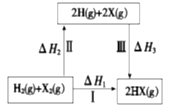
A.过程 II 吸收能量,过程 III 放出能量
B.Cl2(g)+2HBr(g)=Br2(g)+2HCl(g) 该反应能自发进行,则△G﹥0
C.途径I生成HCl时放出的热量比生成HBr时的多,说明生成HCl比生成HBr热力学上趋势更大
D.生成HX的反应热与途径无关,△H1 = △H2 +△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向500 mL0.2 mol/L NaOH溶液中通入SO2气体(忽略反应过程中溶液的体积变化),设反应过程中![]() =x,已知H2SO3的电离平衡常数:Ka1=1.2×10-2,Ka2=5.6×10-8。下列说法正确的是( )
=x,已知H2SO3的电离平衡常数:Ka1=1.2×10-2,Ka2=5.6×10-8。下列说法正确的是( )
A. x=1时,c(SO32-)+c(HSO3-)=0.2 mol/L
B. x<1时,溶液可能为酸性
C. x=![]() 时,c(SO32-)+c(HSO3-)+c(OH-)=c(Na+)+c(H+)
时,c(SO32-)+c(HSO3-)+c(OH-)=c(Na+)+c(H+)
D. x<![]() 时,随通入SO2量增大,
时,随通入SO2量增大,![]() 逐渐减小
逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3;物质结构与性质]
明朝《天工开物》中有世界上最早的关于炼锌技术的记载,锌也是人体必需的微量元素。回答下列问题:
(1)基态Zn原子核外的最高能层符号是________,基态Zn2+最外层电子排布式为________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除Zn外其余元素的电负性由大到小排序为________。
②向[Zn(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是________。
③已知[Zn(NH3)4]2+的空间构型与![]() 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
④在[Zn(NH3)4]SO4晶体中存在的作用力有________。
A.离子键 B.极性共价键 C.氢键
D.配位键 E.范德华力 F.金属键
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是________________________________。
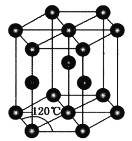
(4)常温下金属锌晶体的晶胞为六方最密堆积(如图所示),若锌原子的半径为rnm,六棱柱的高为![]() ,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A (C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):
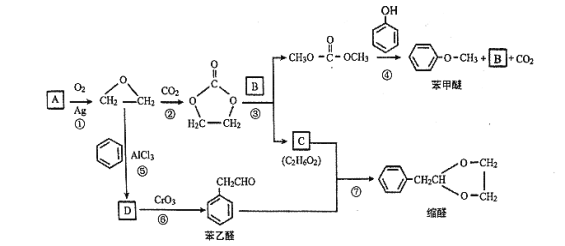
已知:![]()
回答下列问题:
(1)B的分子式是_______,C中含有的官能团名称是_______。
(2)若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为_______,⑥的反应类型是_______。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:_______。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:_______。
i .含有苯环和结构![]()
ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有_______ (不考虑立体异构)种。
(6)参照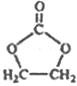 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备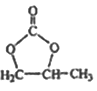 的合成流程图:_______。
的合成流程图:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com