
【题目】据报道,最近有科学家设计了一种在常压下运行的集成BaZrO3基质子陶瓷膜反应器( PCMR) ,将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法正确的是
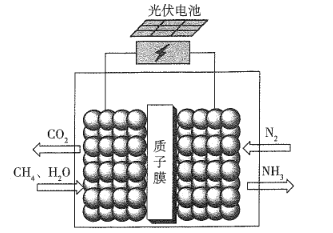
A.阳极的电极反应式为CH4+2H2O+8e-=CO2 +8H+
B.阴极可能发生副反应2H+ +2e- =H2 ↑
C.质子(H+)通过交换膜由阴极区向阳极区移动
D.理论上电路中通过3 mol电子时阴极最多产生22.4 L NH3
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】25℃时,在含有大量PbI2的饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
Pb2+(aq)+2I-(aq),向该饱和溶液中加入KI浓溶液,下列说法正确的是
A. 溶液中Pb2+和I-的浓度都增大 B. PbI2的溶度积常数Ksp增大
C. 沉淀溶解平衡向右移动 D. 溶液中Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
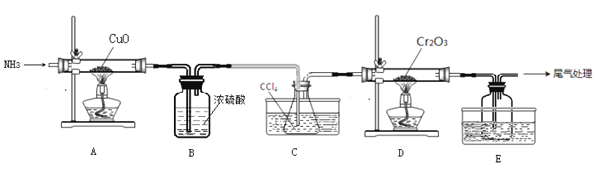
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将ag NH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为bmoL。下列叙述中不正确的是( )
A. 溶质的质量分数为ω=![]() ×100%
×100%
B. 溶质的物质的量浓度c=![]()
C. 溶液中c(OH-)=![]() +c(H+)
+c(H+)
D. 上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】间硝基苯胺是一种重要的有机合成中间体,它是一种黄色针状晶体,微溶于冷水,在水中的溶解度随温度升高而增大,易溶于乙醇、乙醚、甲醇等。实验室制备间硝基苯胺的反应原理及装置如下(夹持及加热装置略去):
4 +6NaHS+H2O→4
+6NaHS+H2O→4 +3Na2S2O3
+3Na2S2O3

实验步骤:
①硫氢化钠溶液的制备。将0.05molNa2S9H2O溶于25mL水中,分批加入4.2gNaHCO3粉末,完全溶解后,慢慢加入30ml.甲醇,冰水浴冷却,立即析出一水合碳酸钠。静置,抽滤,滤饼用15mL甲醇分三次洗涤,合并滤液和洗涤液备用。
②间硝基苯胺的制备。在A中将0.03 mol间二硝基苯溶于40 mL热甲醇中,装上B,从B的顶端加入上述硫氢化钠溶液,水浴加热回流20min。冷却至室温后,改为蒸馏装置,蒸出大部分甲醇,将残液倾入150mL冷水中,立即析出间硝基苯胺粗品,抽滤,洗涤,重结晶,脱色后,得黄色的间硝基苯胺针状晶体2.4 g。回答下列问题:
(1)仪器B的名称是________, 使用时要从_____(填“ a”或“b”)口通入冷水;滴液漏斗的细支管c的作用是________。
(2)写出步骤①中总反应的离子方程式:____________。
(3)步骤①中合并洗涤液的目的是________。
(4)步骤②中制备装置改为蒸馏装置,需增加的仪器除了蒸馏头、温度计、尾接管之外,还有________、________。
(5)步骤②中蒸出大部分甲醇的目的是__________。
(6)步骤②中洗涤粗品使用的洗涤剂为_____;粗品脱色使用的脱色剂可以是______。
(7)本实验的产率为______[保留 2位有效数字;Mr(间硝基苯胺) = 138]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物F和K是重要的药物合成中间体,可通过以下路线合成:
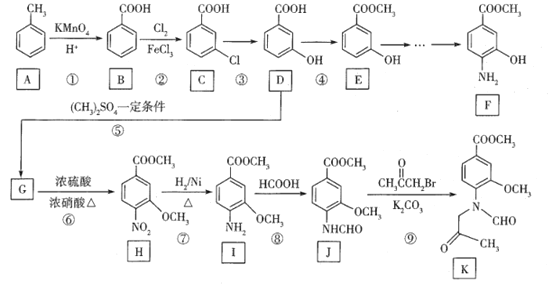
(1)C的化学名称为___________
(2)E中的官能团名称是__________。
(3)反应④所需的试剂和条件分别是___________、_____________。
(4)G的分子式为____________
(5)⑨的反应类型是_____________。
(6)写出符合下列条件的E的同分异构体的结构简式:_________(不考虑立体异构,只需写出3个)。
①能发生银镜反应;②遇FeCl3溶液发生显色反应;③核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1
(7)设计由![]() 和HO(CH2)5OH制备
和HO(CH2)5OH制备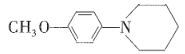 的合成路线:_______(无机试剂任选)。
的合成路线:_______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
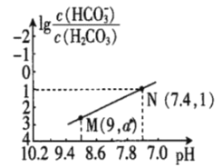
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,如图所示是某厂应用“侯氏制碱法”生产纯碱的工艺流程图,据图回答:
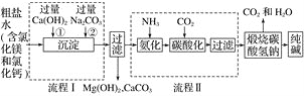
(1)上述流程图中,可循环利用的物质是____________。
(2)流程Ⅰ后过滤所得滤液中含有的溶质有__________。
(3)流程Ⅱ先通入氨气,再通入二氧化碳,如果反过来,二氧化碳的吸收率会降低,这是因为___________。
(4)用一个化学反应方程式表示出流程Ⅱ中发生的总反应____。
(5)工业生产纯碱的流程中,碳酸化时溶液中先析出碳酸氢钠而没有析出氯化铵的原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com