
| A、NH4+ |
| B、N2O |
| C、NO |
| D、NO2 |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、放电时正极反应为:Zn-2e-+2OH-═Zn(OH)2 |
| B、该原电池,Zn作正极,可用石墨等作负极 |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
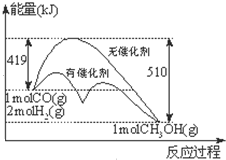 反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中能量的变化如图示.下列判断不正确的是( )| A、达到平衡时,升高温度,CO的转化率减小 |
| B、1mol CO(g)和2mol H2(g)在密闭容器中反应,达平衡时,放出的热量为91KJ |
| C、相同条件下,1mol CO(g)和2mol H2(g)完全反应生成1mol液态CH3OH放出的热量大于91KJ |
| D、反应热取决于反应物总能量与生成物总能量的相对大小,与反应发生的条件无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A中SO2和H2的体积比为4:1 |
| B、气体A是SO2和H2的混合物 |
| C、反应中共消耗锌97.5g |
| D、反应中共转移电子3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解时以精铜作阴极 |
| B、电解时阴极发生还原反应 |
| C、粗铜连接电源负极,其电极反应有:Cu-2e-=Cu2+、Fe-2e-=Fe2+、Zn-2e-=Zn2+ |
| D、电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第16列元素的最高价氧化物的化学式为RO3 |
| B、第2列元素中一定没有非金属元素 |
| C、第15列元素的最高价氧化物对应的水化物的化学式可能为H3RO4 |
| D、某元素的离子最外层电子数与次外层相同,该元素一定位于第三周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3溶液中混有少量Na2CO3:往该溶液中加入过量Ca(HCO3)2溶液 |
| B、CO2中混有HCl:将其通入饱和NaHCO3溶液 |
| C、铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 |
| D、NaCl固体中混有少量I2:充分加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com