
A、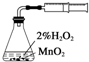 测定化学反应速率 |
B、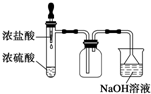 制取并吸收Cl2 |
C、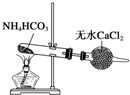 制备纯净的NH3 |
D、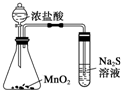 比较MnO2、Cl2、S的氧化性 |


科目:高中化学 来源: 题型:
| A、9 | B、12 | C、16 | D、20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+ |
| B、N2O |
| C、NO |
| D、NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
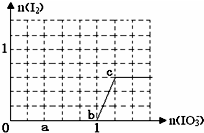 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A、0--b:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B、a点时消耗NaHSO3的物质的量为1.2 mol |
| C、b-c间I2是既是还原产物又是氧化产物 |
| D、当溶液中I?与I2的物质的量之比为5:2时,加入的KIO3为1.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的1/5 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有最高正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Al |
| 高温 |
| 电解精炼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com