
【题目】某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。

(1)A中制取乙炔的化学方程式为_______________________________________________。
(2)制乙炔时,旋开分液漏斗的活塞,使水缓慢滴下的原因是________________________,分液漏斗里的液体通常用___________________。
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用________(填字母,下同)装置,气体应从________进;干燥乙炔最好选用________装置。
【答案】CaC2+2H2O→C2H2↑+Ca(OH)2 控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管(写到“控制反应速率”或“减缓反应速率”即可满分) 饱和食盐水 C d D
【解析】
(1)制取乙炔使用电石(碳化钙)和水反应;
(2)因为CaC2与H2O反应剧烈,产生C2H2的速率很快,故应控制H2O的滴速来达到控制反应速率,防止产生的泡沫进入导气管;也可用饱和食盐水代替水来减慢反应速率;
(3)根据乙炔制取实验分析;乙炔中含有H2S、PH3等杂质,可用硫酸铜溶液除去,然后用碱石灰干燥。
(1)制取乙炔使用电石(碳化钙)和水反应生产乙炔和氢氧化钙: CaC2+2H2O→C2H2↑+Ca(OH)2;因此,本题正确答案是: CaC2+2H2O→C2H2↑+Ca(OH)2。
(2)因为CaC2与H2O 反应剧烈,产生C2H2的速率很快,故应控制H2O的滴速来达到控制反应速率,防止产生的泡沫进入导气管;分为减缓反应速率,通常用饱和食盐水代替水,因此液漏斗里的液体通常用饱和食盐水;因此,本题正确答案是: 控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管(写到“控制反应速率”或“减缓反应速率”即可满分);饱和食盐水。
(3) H2S、PH3等杂质均能被CuSO4溶液吸收,硫化氢和硫酸铜反应生成CuS沉淀,PH3易溶于水,选用C装置; 导气管应“长进短出”,即从d进;碱石灰是NaOH、CaO的混合物,其干燥效率优于CaCl2,故用D装置干燥C2H2;
综上所述,本题答案是:C,d,D。


科目:高中化学 来源: 题型:
【题目】现有四种短周期元素A,B,C,D,已知:①C,D在同一周期,A,B在同一主族;②它们可以组成化合物A2C、B2C2、DC2、D2A4等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应生成气体A2,A2与气体C2按体积比2∶1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体。请回答:
(1)写出元素符号:A________、B________、C________、D________。
(2)在A2C、B2C2、DC2和D2A4中,同时含有离子键和非极性共价键的化合物的电子式为__________;按原子轨道重叠方式,其非极性键的类型是________。化合物DC2的结构式__________。
(3)A2C分子的电子式____________,按原子轨道重叠方式,其共价键的类型是____________。D2A4是平面形分子,其分子中含有______个σ键,______个π键。
(4)写出化学方程式或离子方程式:
B2C2与A2C反应的化学方程式:___________________________________________;
B2C2与DC2反应的化学方程式:___________________________________________;
B与A2C反应的离子方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(L.Pauling)教授的诞辰100周年。1994年这位老人谢世后,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它能合成吗?它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜,也许有朝一日你就能解开它。不管结果如何,让我们先对这个结构作一番了解。

(1)它的分子式是__________________________________________________________。
(2)它的所有原子是否可能处于同一个平面上?________(填“可能”或“不可能”)。
(3)它是否带有电荷?________(填“是”或“否”)。
(4)该分子中sp杂化的氮原子有___个;sp2杂化的氮原子有___个;sp3杂化的氮原子有_____个。
(5)为什么人们推测它是炸药?______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:

下列叙述错误的是
A. 实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B. 装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C. 向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4Cl
D. 用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①CH3CH2CH3 ②CH3CH2CH2CH3 ③CH3CH2CH2CH2CH3 ④![]()
⑤ ⑥CH3CH2CH2CH2CH2CH3
⑥CH3CH2CH2CH2CH2CH3
上述物质的沸点按由高到低的顺序排列的是( )
A. ⑥③④⑤②① B. ⑥③②①④⑤ C. ⑤④⑥③②① D. ⑥⑤④③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g)![]() 3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
A. B和C可能都是固体 B. 若C为固体,则B一定是气体
C. B和C一定都是气体 D. B和C不可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
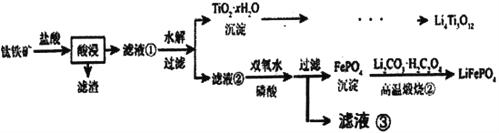
已知:“酸浸”后,钛主要以TiOCl42-形式存在
FeTiO3+4H++4C1-=Fe2++ TiOCl42-+2H2O
下列说法不正确的是
A. Li2Ti5O15中Ti的化合价为+4,其中有4个过氧键
B. 滤液②中的阳离子除了Fe2+和H+,还有Mg2+
C. 滤液②中也可以直接加适量的氯水代替双氧水
D. “高温煅烧②”过程中,Fe元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示2Na+2H2O═2NaOH+H2↑中的相关微粒,其中正确的是( )
A. 中子数为8的氧原子:88O
B. NaOH的电子式:![]()
C. H2O的结构式:![]()
D. Na+的结构示意图:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯在NaBH4、ZnCl2等作用下可转化为醇,其中NaBH4转化为H3BO3:

(1)Zn2+基态核外电子排布式为_____。
(2)苯甲醇(![]() )中碳原子的杂化轨道类型为_____。
)中碳原子的杂化轨道类型为_____。
(3)1mol苯甲酸甲酯(![]() )分子中含有σ键的数目为_____mol。
)分子中含有σ键的数目为_____mol。
(4)与BH4﹣互为等电子体的阳离子为_____(填化学式),BH4﹣离子的空间构型为(用文字描述)_____。
(5)硼酸是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图所示)。1molH3BO3晶体中有_____mol氢键。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com