
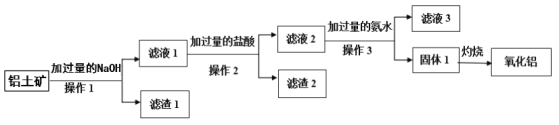
����Ŀ����ҵ����������(��Ҫ�ɷ���Al2O3����SiO2��Fe2O3������)��ȡ��������ұ������ԭ�ϣ��乤����������ͼ��ʾ��
��ش��������⡣
(1)����1��2��3�����ƾ�Ϊ__________��
(2)��Һ1�������������ӳ�OH-�⣬����________��_______(�����ӷ���)������2 �ijɷ�Ϊ_________(�ѧʽ)��
(3)��Һ2�м��������ˮ���ɹ���1�����ӷ�Ӧ����ʽΪ_________��
(4)��Һ3�����ʵ���Ҫ�ɷ����������������_______��________(�ѧʽ)��
(5)����1���շ�����Ӧ�Ļ�ѧ����ʽΪ________��
���𰸡����� ![]() [Al(OH)4]-��
[Al(OH)4]-��![]() H2SiO3 3NH3��H2O+Al3+=Al(OH)3��+3
H2SiO3 3NH3��H2O+Al3+=Al(OH)3��+3![]() NH4Cl NaCl 2Al(OH)
NH4Cl NaCl 2Al(OH) ![]() Al2O3+3H2O
Al2O3+3H2O
��������
�������м��������NaOH��Һ��Fe2O3���������Ʋ���Ӧ���������������������ܷ�Ӧ������1���ù��˳�ȥFe2O3������1Ϊ�������Ȳ������Һ1����ƫ�����ơ������ƣ�����Һ1�м�����������ᣬ![]() ת��ΪAl3+������H2SiO3����������2���ù��˳�ȥH2SiO3������2ΪH2SiO3����Һ2��Ҫ��AlCl3��NaCl������Һ2���ټ��백ˮ����Al(OH)3����������3���ˣ���Һ3��Ҫ��NaCl��NH4Cl������1ΪAl(OH)3�����ȷֽ����������õ���������
ת��ΪAl3+������H2SiO3����������2���ù��˳�ȥH2SiO3������2ΪH2SiO3����Һ2��Ҫ��AlCl3��NaCl������Һ2���ټ��백ˮ����Al(OH)3����������3���ˣ���Һ3��Ҫ��NaCl��NH4Cl������1ΪAl(OH)3�����ȷֽ����������õ���������
������������֪��
��1������1��2��3���Ƿ������ܹ�������Һ�ķ����ǹ��ˣ���Ϊ���ˡ�
��2����Һ1�������������ӳ�OH-�⣬����![]() ��
��![]() ��[Al(OH)4]-������2 �ijɷ�ΪH2SiO3����Ϊ
��[Al(OH)4]-������2 �ijɷ�ΪH2SiO3����Ϊ![]() ��
��![]() ��[Al(OH)4]-��H2SiO3��
��[Al(OH)4]-��H2SiO3��
��3����Һ2�м��������ˮ���ɹ���1����Al3+�백ˮ������Ӧ����Al(OH)3���������ӷ�Ӧ����ʽΪ3NH3��H2O+Al3+=Al(OH)3��+3![]() ����Ϊ3NH3��H2O+Al3+=Al(OH)3��+3
����Ϊ3NH3��H2O+Al3+=Al(OH)3��+3![]() ��
��
��4����Һ3�����ʵ���Ҫ�ɷ����������������NH4Cl��NaCl����ΪNH4Cl��NaCl��
��5��Al(OH)3���ȷֽ�����Al2O3��H2O����ѧ����ʽΪ2Al(OH)3![]() Al2O3+3H2O����Ϊ2Al(OH)3
Al2O3+3H2O����Ϊ2Al(OH)3![]() Al2O3+3H2O��
Al2O3+3H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����Ȼ���е�ѭ������ͼ����˵������ȷ���ǣ�
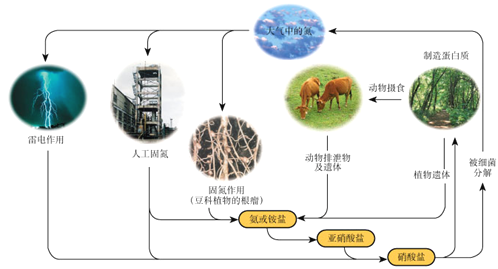
A. ��Ԫ�ؾ�������
B. ��ҵ�ϳɰ������˹��̵�
C. ��������ͺ����л�����ת��
D. ̼���⡢������Ԫ��Ҳ�����˵�ѭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ���й�Ӧ�õ������У�����ȷ����
A.��ͬ��ͬѹ�£��Ȼ�ѧ����ʽ2H2(g)��O2(g)==2H2O(l)��H1��2H2(g)��O2(g)==2H2O(g)��H2����Ӧ����H1��H2
B.��֪ǿ����ǿ����ϡ��Һ�ﷴӦ���к���Ϊ57.3kJmol-1����![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)�T
Ba(OH)2(aq)�T![]() BaSO4(s)+H2O(l)��H��57.3kJmol-1
BaSO4(s)+H2O(l)��H��57.3kJmol-1
C.500�桢30MPa�£���0.5molN2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ����N2(g)+3H2(g)![]() 2NH3(g)��H��38.6kJmol-1
2NH3(g)��H��38.6kJmol-1
D.�����ȼ����Ϊ890.3kJmol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+![]() O2(g)�TCO(g)+2H2O(l)��H=��890.3kJmol-1
O2(g)�TCO(g)+2H2O(l)��H=��890.3kJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
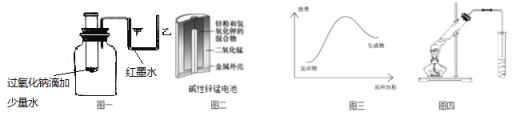
A.ͼһ�ɱ�ʾģ�ⷴӦ�������仯����Ӧ�����Һ���������Ҳ�Һ���½�
B.ͼ����ʾ����У�MnO2�������Ǵ���
C.ͼ���ɱ�ʾ����ȵķ��ȷ�Ӧ
D.ͼ�Ŀ�����������Ҵ���������Ӧ��С�Թ����DZ���̼������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����̷��з��ֵĻ���ԭ�������谷���������з�Ӧ�ϳɣ�CaO��3C ![]() CaC2��CO����CaC2��N2
CaC2��CO����CaC2��N2 ![]() CaCN2��C��CaCN2��2H2O=NH2CN��Ca(OH)2��NH2CN��ˮ��Ӧ��������[CO(NH2)2]�����غϳ������谷��
CaCN2��C��CaCN2��2H2O=NH2CN��Ca(OH)2��NH2CN��ˮ��Ӧ��������[CO(NH2)2]�����غϳ������谷��
��1��д����Ca��ͬһ������δ�ɶԵ��������Ļ�̬ԭ�ӵĵ����Ų�ʽ��___________��CaCN2��������ΪCN22-����CN22-��Ϊ�ȵ�����ķ�����N2O���ɴ˿�����֪CN22-�Ŀռ乹��Ϊ________��
��2��1mol���ط���[CO��NH2��2]�к��е���������������Ŀ֮��Ϊ_______��
��3�������谷�׳�������������ṹΪ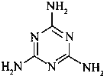 �����е�ԭ�ӵ��ӻ���ʽ��_____________��
�����е�ԭ�ӵ��ӻ���ʽ��_____________��
��4��CaO������ͼ��ʾ��CaO������Ca2������λ��Ϊ______��Ca2����ȡ�Ķѻ���ʽΪ____________������O2-����Ca2���ѻ��γɵİ������϶�У���֪CaO������ܶ�Ϊ�������о������������������֮��ľ���_____________���г�����ʽ����
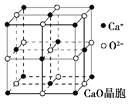
��5����λ������K3[Fe(CN)n]���������ӻ������ɫ��������˿����ڼ����������ӣ���֪��ԭ�ӵ������������������ṩ������֮��Ϊ14����n=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û��������Ժܺõ���������ˮ����NO3-��ɵ���Ⱦ����ȥԭ����ͼ��ʾ������˵������ȷ����
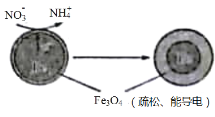
A.���缫�ĵ缫��Ӧʽ��3Fe-8e-+4H2O=Fe3O4+8H+
B.NO3-�ڸ����Ϸ�����ԭ��Ӧ
C.��NO3-�Ĺ�����ˮ��pH��С
D.����·����4 mol����ת��ʱ����Һ�л���1 mol NH4+����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ����������
A. pH=7����Һ��K����Na����Cl����Fe3+
B. ��ʹ��̪�Ժ�ɫ����Һ��Na����Mg2����HCO3-��SO42-
C. c(H��)/c(OH��)��1012����Һ��K����Fe3����Cl����SO42-
D. ˮ�������c(H��)��10��13 mol��L��1����Һ��Ca2����NH4+��NO3-��HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ѿ���SO2���ʹ����Ϊ0.25 g��L��1��ȡ300.00 mL���Ѿƣ�ͨ���ʵ��ķ���ʹ����SO2ȫ���ݳ�����H2O2����ȫ������ΪH2SO4��Ȼ����0.090 0 mol��L��1NaOH����Һ���еζ���
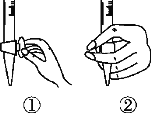
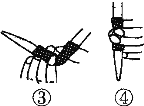
��1���ζ�ǰ������ʱ��Ӧѡ����ͼ�е�________(�����)��
��2������50 mL�ζ��ܽ���ʵ�飬���ζ����е�Һ���ڿ̶���10�����������Һ������______(�����)��
�٣�10 mL �ڣ�40 mL �ۣ�10 mL �ܣ�40 mL��
��3�������ζ�ʵ���У���ѡ��_______Ϊָʾ����ѡ���ָʾ��ʱ����жϷ�Ӧ����ζ��յ㣺______
��4���ζ����յ�ʱ������NaOH��Һ25.00 mL�������Ѿ���SO2����Ϊ________g��L��1���ζ��յ����ʱ���ӿ̶��ߣ�����������ʵ��ֵ________������ƫ��������ƫ����������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����£���O2����һ��Ũ�ȵ�FeCl2��Һ�����������ʵ��������ͼ��ʾ�����з������Ʋ�����������
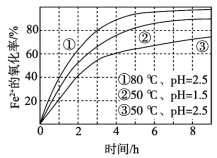
A. Fe2+����������ʱ���ӳ���������
B. �ɢں͢ۿ�֪��pHԽ��Fe2+��������Խ��
C. �ɢٺ͢ۿ�֪���¶�Խ�ߣ�Fe2+��������Խ��
D. �������̵����ӷ���ʽΪ��4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com