
【题目】葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
(1)滴定前排气泡时,应选择下图中的________(填序号)。
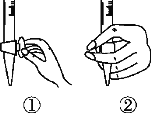
(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积______(填序号)。
①=10 mL ②=40 mL ③<10 mL ④>40 mL。
(3)上述滴定实验中,可选择_______为指示剂,选择该指示剂时如何判断反应到达滴定终点:______
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
【答案】③ ④ 酚酞 当加入最后一滴标准溶液后,溶液恰好变红色,且在半分钟内无变化,说明到达滴定终点 0.24 偏低
【解析】
(1)氢氧化钠是强碱,应用碱式滴定管量取;
(2)滴定管0刻度在上,且下端有一段没有刻度线;
(3)强碱滴定酸用酚酞;
(4)由SO2~H2SO4~2NaOH关系计算。滴定管0刻度在上,俯视读数偏小,标准液体积偏小。
(1)氢氧化钠是强碱,应用碱式滴定管量取,排液时应将橡皮管向上弯曲排出气泡,答案选③;
(2)滴定管0刻度在上,且下端有一段没有刻度线,故管内液体的体积大于40 mL,答案选④;
(3)强碱滴定酸用酚酞,滴定至终点时溶液的pH在酚酞的变色范围内,故可选用酚酞作指示剂。选择酚酞时反应到达滴定终点现象为:当加入最后一滴标准溶液后,溶液恰好变红色,且在半分钟内无变化;
(4)SO2与NaOH存在如下关系:
SO2 ~ H2SO4 ~ 2NaOH
64 g 2 mol
m(SO2) 0.090 0 mol·L-1×0.025 L
解得:m(SO2)=![]() =0.072 g,故葡萄酒中SO2的含量为
=0.072 g,故葡萄酒中SO2的含量为![]() ==0.24 g·L-1。滴定管0刻度在上,俯视读数偏小,标准液体积偏小,故测量结果比实际值偏低。
==0.24 g·L-1。滴定管0刻度在上,俯视读数偏小,标准液体积偏小,故测量结果比实际值偏低。


科目:高中化学 来源: 题型:
【题目】己知乙烯能发生以下转化:
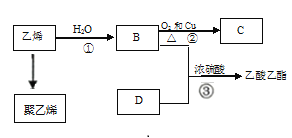
(1)写出化合物中的官能团的化学式或名称:B中所含官能团名称_;D中所含官能团化学式__;
(2)写出反应的化学方程式:
①_____________________, 反应类型:_____________;
②_____________________ , 反应类型:_____________;
③_____________________ , 反应类型:_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶炼铝的原料,其工艺流程如下图所示:
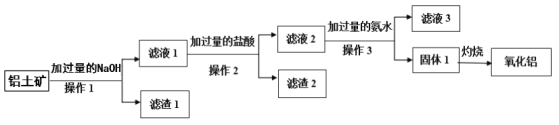
请回答下列问题。
(1)操作1、2、3的名称均为__________。
(2)滤液1中所含的阴离子除OH-外,还有________、_______(填离子符号),滤渣2 的成份为_________(填化学式)。
(3)滤液2中加入过量氨水生成固体1的离子反应方程式为_________。
(4)滤液3中溶质的主要成份属于盐类的物质是_______、________(填化学式)。
(5)固体1灼烧发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)②的原子结构示意图是___________。
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)③和④原子中,原子半径较大的是___________(填元素符号)。
(4)常用作半导体材料的是___________(填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是_________(填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是___________(填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是___________(填化学式)。
(8)结构简式为![]() 的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物![]() 的重要用途之一是生产汽车刹车片,其合成路线如图所示:
的重要用途之一是生产汽车刹车片,其合成路线如图所示:

已知:![]() +
+![]()
![]()
![]()
(1)A→B的反应类型属于_____________,D的名称是_____________,烃F的分子式为____________。
(2)E中含有官能团的名称是___________,C的结构简式为____________。
(3)用文字叙述淀粉转化为A的原理:___________。
(4)写出G→H的化学方程式:__________。
(5)烃F有多种同分异构体,写出其同分异构体中含有2个相同官能团且无支链的链状物质的结构简式:_____(任写三种),其中核磁共振氢谱峰最少的一种物质有______个峰。
(6)写出以2—甲基—1,3—丁二烯和丙烯为原料合成![]() 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.红褐色固体![]() 全部溶于氢碘酸:
全部溶于氢碘酸:![]()
B.水杨酸溶于![]() 溶液中:
溶液中:![]()
C.将等浓度的![]() 溶液与
溶液与![]() 液按体积比2:3混合:
液按体积比2:3混合:![]()
D.洁厕灵(含![]() )与84消毒液混合后产生氯气:
)与84消毒液混合后产生氯气:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
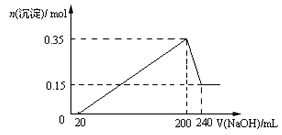
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮的碘代反应![]() 的速率方程为
的速率方程为![]() ,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为![]() 改变反应物浓度时,反应的瞬时速率如表所示。
改变反应物浓度时,反应的瞬时速率如表所示。
|
|
|
0.25 | 0.050 | 1.4 |
0.50 | 0.050 | 2.8 |
1.00 | 0.050 | 5.6 |
0.50 | 0.100 | 2.8 |
下列说法正确的是( )
A.速率方程中的![]() 、
、![]()
B.该反应的速率常数![]()
C.增大![]() 的浓度,反应的瞬时速率加快
的浓度,反应的瞬时速率加快
D.在过量的![]() 存在时,反应掉87.5%的
存在时,反应掉87.5%的![]() 所需的时间是375min
所需的时间是375min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧生成SO2气体,放出的热量一样多
B.由C(石墨)=C(金刚石) ΔH=+1.90kJ·mol-1可知,金刚石比石墨稳定
C.2CO(g)+O2(g)=2CO2(g) ΔH<0,则56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
D.已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1,则相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放出92.4kJ的热量
2NH3(g) ΔH=-92.4kJ·mol-1,则相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放出92.4kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com