
【题目】下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)②的原子结构示意图是___________。
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)③和④原子中,原子半径较大的是___________(填元素符号)。
(4)常用作半导体材料的是___________(填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是_________(填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是___________(填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是___________(填化学式)。
(8)结构简式为![]() 的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
【答案】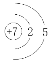 Ar O 硅 HClO4 Na Al(OH)3 C6H6 12:1
Ar O 硅 HClO4 Na Al(OH)3 C6H6 12:1
【解析】
由元素的位置可知,①为C,②为N,③为O,④为F,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,⑩为Ar,
(1)②为N,原子结构示意图是 ,故答案为:
,故答案为: ;
;
(2)化学性质最不活泼的元素是稀有气体Ar,因其核外电子排布为稳定结构,故答案为:Ar;
(3)③和④为同周期元素,原子半径从左到右随核电荷数增加而减小,因此O的原子半径大于F,故答案为:O;
(4)常用作半导体材料为金属与非金属交界的元素Si,名称为硅,故答案为:硅;
(5) ⑧为S,⑨为Cl,非金属性Cl>S,非金属性越强,最高价氧化物的水化物酸性越强,即酸性:HClO4>H2SO4,故答案为:HClO4;
(6)焰色反应显黄色的物质所含的金属元素是钠,故答案为:Na;
(7)元素最高价氧化物对应的水化物中,呈两性的是氢氧化铝,故答案为:Al(OH)3;
(8)结构简式为![]() ,分子式为C6H6,C、H个数比为1:1,质量比为12:1,故答案为:C6H6;12:1;
,分子式为C6H6,C、H个数比为1:1,质量比为12:1,故答案为:C6H6;12:1;


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
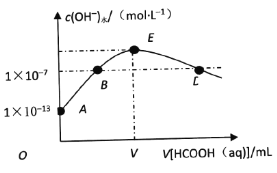
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
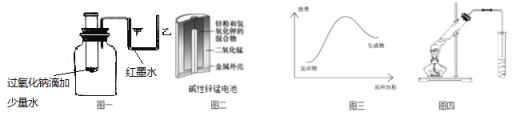
A.图一可表示模拟反应的能量变化,反应后左侧液面上升,右侧液面下降
B.图二所示电池中,MnO2的作用是催化剂
C.图三可表示需加热的放热反应
D.图四可用于乙酸和乙醇的酯化反应,小试管中是饱和碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用活性铁可以很好地消除酸性水体中NO3-造成的污染,除去原理如图所示。下列说法中正确的是
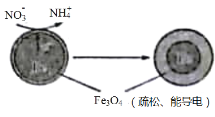
A.铁电极的电极反应式:3Fe-8e-+4H2O=Fe3O4+8H+
B.NO3-在负极上发生还原反应
C.除NO3-的过程中水体pH减小
D.当电路中有4 mol电子转移时,溶液中会有1 mol NH4+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. pH=7的溶液:K+、Na+、Cl-、Fe3+
B. 能使酚酞显红色的溶液:Na+、Mg2+、HCO3-、SO42-
C. c(H+)/c(OH-)=1012的溶液:K+、Fe3+、Cl-、SO42-
D. 水电离出的c(H+)=10-13 mol·L-1的溶液:Ca2+、NH4+、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱如图:
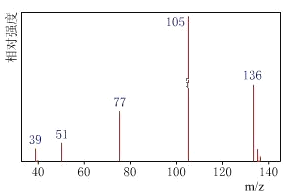
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶2∶2∶3。
方法三:利用红外光谱仪测得A分子的红外光谱,如图:
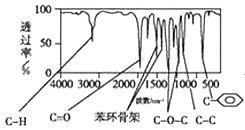
(1)分子中共有____种化学环境不同的氢原子。
(2)A的分子式为____。
(3)该物质属于哪一类有机物____。
(4)A的分子中只含一个甲基的依据是____(填序号)。
a A的相对分子质量 b A的分子式
c A的核磁共振氢谱图 d A分子的红外光谱图
(5)A的结构简式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
(1)滴定前排气泡时,应选择下图中的________(填序号)。
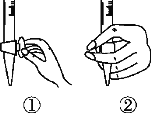
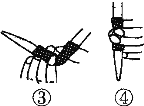
(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积______(填序号)。
①=10 mL ②=40 mL ③<10 mL ④>40 mL。
(3)上述滴定实验中,可选择_______为指示剂,选择该指示剂时如何判断反应到达滴定终点:______
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
实验① | 实验② | 实验③ |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
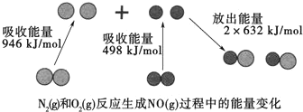
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会________(填“吸收”或“放出”)________kJ能量。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请将表中数据补充完整:a___________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
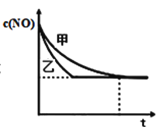
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。
④在容积固定的容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com