
【题目】下列说法正确的是
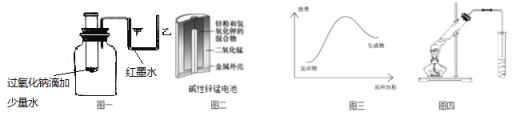
A.图一可表示模拟反应的能量变化,反应后左侧液面上升,右侧液面下降
B.图二所示电池中,MnO2的作用是催化剂
C.图三可表示需加热的放热反应
D.图四可用于乙酸和乙醇的酯化反应,小试管中是饱和碳酸钠溶液
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】I.氢气在工业合成中应用广泛。
(1)通过下列反应可以制备甲醇
①CO(g)+2H2(g)=CH3OH(g) △H=-90.8kJ·mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.3kJ·mol-1
请写出由CO2和H2制取甲醇的热化学方程式:______________________。
Ⅱ.CH4可以消除氮氧化物的污染,主要反应原理为
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-868.7kJ·mol-1
(2)在3.00L密闭容器中通入1 mol CH4和2 mol NO2,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 |
总压强P/×100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
由表中数据计算,0~4min内v(NO2)=___________,该温度下的平衡常数K=___________。
(3)在一恒容装置中通入一定量CH4和NO2,测得在相同时间内和不同温度下,NO2的转化率如下图。则下列叙述正确的是___________。

A 若温度维持在200℃更长时间,NO2的转化率将大于19%
B 反应速率b点的v(逆)>e点的(逆)
C 平衡常数:c点=d点
D b点反应未达到平衡
(4)利用氨气可以设计高能环保燃料电池,用该电池电解含有NO3-的碱性工业废水,在阴极产生N2。阴极的电极反应式为______________________;在标准状况下,当阴极收集到13.44LN2时,理论上消耗NH3的体积为___________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在 NH4HCO3溶液中c(NH4+)___________c(HCO3-)(填“>”“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=___________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=___________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知乙烯能发生以下转化:
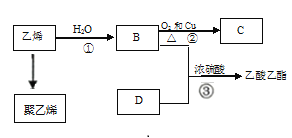
(1)写出化合物中的官能团的化学式或名称:B中所含官能团名称_;D中所含官能团化学式__;
(2)写出反应的化学方程式:
①_____________________, 反应类型:_____________;
②_____________________ , 反应类型:_____________;
③_____________________ , 反应类型:_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针 |
1 | Mg、Al | 稀盐酸 | 偏转 |
2 | Al、Cu | 稀盐酸 | 偏转 |
3 | Al、C(石墨) | 稀盐酸 | 偏转 |
4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
5 | Al、Zn | 浓硝酸 | 偏转 |
下列回答错误的是
A.实验1、2中铝所作的电极(正极或负极)不相同
B.实验2、3,铝电极的电极反应式均为Al-3e-=Al3+
C.实验4中铝电极的电极反应式为Al-3e-+4OH-=![]() +2H2O
+2H2O
D.实验5中铝始终作原电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
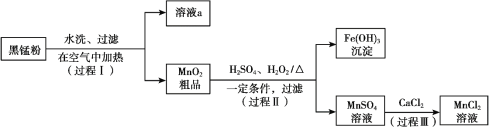
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
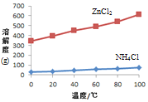
① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属及其化合物在生产、生活中应用广泛。
Ⅰ.CO2的有效利用可以缓解温室效应和能源短缺问题,CO2的分子结构决定了其性质和用途。
(1)CO2的电子式是______,包含的化学键类型为______共价键(填“非极性”或“极性”)。
(2)在温度高于31.26 oC、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有______(答出一点即可)。
Ⅱ.氯水以及氯的化合物经常用于饮用水的消毒。
(3)将铁片插入盛有少量新制氯水的试管中,无气泡产生,用长滴管吸取KSCN溶液滴入铁片附近,溶液变红色,然后红色消失。显红色的离子方程式为______。
(4)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。
①优氯净中氯元素的化合价为___________。
②亚硫酸钠将水中多余次氯酸除去的反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶炼铝的原料,其工艺流程如下图所示:
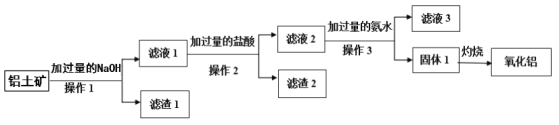
请回答下列问题。
(1)操作1、2、3的名称均为__________。
(2)滤液1中所含的阴离子除OH-外,还有________、_______(填离子符号),滤渣2 的成份为_________(填化学式)。
(3)滤液2中加入过量氨水生成固体1的离子反应方程式为_________。
(4)滤液3中溶质的主要成份属于盐类的物质是_______、________(填化学式)。
(5)固体1灼烧发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)②的原子结构示意图是___________。
(2)化学性质最不活泼的元素是___________(填元素符号)。
(3)③和④原子中,原子半径较大的是___________(填元素符号)。
(4)常用作半导体材料的是___________(填名称)。
(5)⑧、⑨的最高价氧化物对应的水化物中酸性较强的是_________(填化学式)。
(6)焰色反应显黄色的物质所含的金属元素是___________(填元素符号)。
(7)元素最高价氧化物对应的水化物中,呈两性的是___________(填化学式)。
(8)结构简式为![]() 的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
的有机物分子式是_____,其中碳元素与氢元素的质量比m(C)∶(H)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮的碘代反应![]() 的速率方程为
的速率方程为![]() ,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为![]() 改变反应物浓度时,反应的瞬时速率如表所示。
改变反应物浓度时,反应的瞬时速率如表所示。
|
|
|
0.25 | 0.050 | 1.4 |
0.50 | 0.050 | 2.8 |
1.00 | 0.050 | 5.6 |
0.50 | 0.100 | 2.8 |
下列说法正确的是( )
A.速率方程中的![]() 、
、![]()
B.该反应的速率常数![]()
C.增大![]() 的浓度,反应的瞬时速率加快
的浓度,反应的瞬时速率加快
D.在过量的![]() 存在时,反应掉87.5%的
存在时,反应掉87.5%的![]() 所需的时间是375min
所需的时间是375min
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com