
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针 |
1 | Mg、Al | 稀盐酸 | 偏转 |
2 | Al、Cu | 稀盐酸 | 偏转 |
3 | Al、C(石墨) | 稀盐酸 | 偏转 |
4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
5 | Al、Zn | 浓硝酸 | 偏转 |
下列回答错误的是
A.实验1、2中铝所作的电极(正极或负极)不相同
B.实验2、3,铝电极的电极反应式均为Al-3e-=Al3+
C.实验4中铝电极的电极反应式为Al-3e-+4OH-=![]() +2H2O
+2H2O
D.实验5中铝始终作原电池的负极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mLcmol·L-1KOH溶液中滴加0.1mol·L-1HCOOH溶液,混合溶液中水电离的氢氧根离子浓度与滴加甲酸(弱酸)溶液体积(V)的关系如图所示。下列说法正确的是
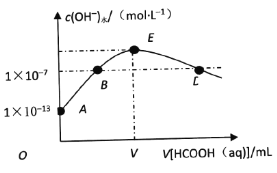
A. 上述KOH溶液的浓度c=0.01mol·L-1
B. B点对应的溶液中:c(K+)=c(HCOO-)
C. E点对应的溶液中:c(OH-)>c(H+)=c(HCOOH)
D. 若D点对应的甲酸溶液体积为V1mL,则HCOOH电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于汽车刹车片的聚合物 Y 是一种聚酰胺纤维,合成路线如图:
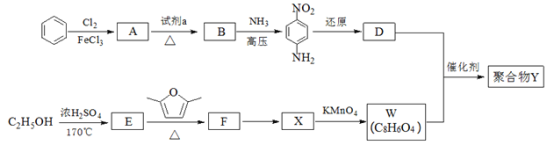
已知:![]()
(1)生成 A 的反应类型是_____。
(2)试剂 a 是_____。
(3)B 中所含的官能团的名称是_____。
(4)W、D 均为芳香化合物,分子中均只含两种不同化学环境的氢原子。
①F 的结构简式是_____。
②生成聚合物 Y 的化学方程式是_____。
(5)Q 是 W 的同系物且相对分子质量比 W 大 14,则 Q 有______种,其中核磁共振氢谱有4 组峰,且峰面积比为 1∶2∶2∶3 的为___________(写一种结构简式即可)。
(6)试写出由 1,3﹣丁二烯和乙炔为原料(无机试剂及催化剂任用)合成![]() 的合成路线__________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的合成路线__________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,不正确的是
A.在同温同压下,热化学方程式2H2(g)+O2(g)==2H2O(l)ΔH1;2H2(g)+O2(g)==2H2O(g)ΔH2,反应热ΔH1ΔH2
B.已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l)△H-57.3kJmol-1
BaSO4(s)+H2O(l)△H-57.3kJmol-1
C.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,则:N2(g)+3H2(g)![]() 2NH3(g)△H-38.6kJmol-1
2NH3(g)△H-38.6kJmol-1
D.甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+![]() O2(g)═CO(g)+2H2O(l)△H=-890.3kJmol-1
O2(g)═CO(g)+2H2O(l)△H=-890.3kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4的下列说法中错误的是
A. CuSO4在反应中被还原
B. FeS2既是氧化剂也是还原剂
C. 14 mol CuSO4氧化了1 mol FeS2
D. 被还原的S和被氧化的S的质量之比为3∶7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
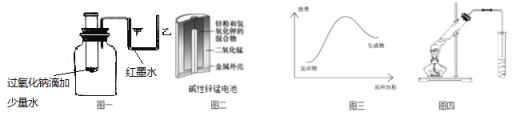
A.图一可表示模拟反应的能量变化,反应后左侧液面上升,右侧液面下降
B.图二所示电池中,MnO2的作用是催化剂
C.图三可表示需加热的放热反应
D.图四可用于乙酸和乙醇的酯化反应,小试管中是饱和碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用活性铁可以很好地消除酸性水体中NO3-造成的污染,除去原理如图所示。下列说法中正确的是
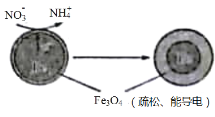
A.铁电极的电极反应式:3Fe-8e-+4H2O=Fe3O4+8H+
B.NO3-在负极上发生还原反应
C.除NO3-的过程中水体pH减小
D.当电路中有4 mol电子转移时,溶液中会有1 mol NH4+生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
实验① | 实验② | 实验③ |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com