
【题目】用于汽车刹车片的聚合物 Y 是一种聚酰胺纤维,合成路线如图:
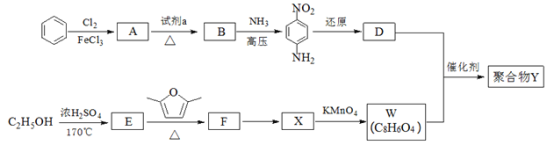
已知:![]()
(1)生成 A 的反应类型是_____。
(2)试剂 a 是_____。
(3)B 中所含的官能团的名称是_____。
(4)W、D 均为芳香化合物,分子中均只含两种不同化学环境的氢原子。
①F 的结构简式是_____。
②生成聚合物 Y 的化学方程式是_____。
(5)Q 是 W 的同系物且相对分子质量比 W 大 14,则 Q 有______种,其中核磁共振氢谱有4 组峰,且峰面积比为 1∶2∶2∶3 的为___________(写一种结构简式即可)。
(6)试写出由 1,3﹣丁二烯和乙炔为原料(无机试剂及催化剂任用)合成![]() 的合成路线__________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的合成路线__________________。(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
【答案】取代反应 浓硝酸、浓硫酸 氯原子、硝基 ![]()
 +(2n-1)H2O 10
+(2n-1)H2O 10 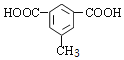 或
或 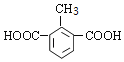
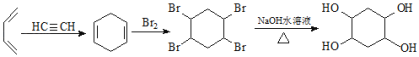
【解析】
苯与氯气在氯化铁作催化剂条件下得到A是![]() ,A转化得到B,B与氨气在高压下得到
,A转化得到B,B与氨气在高压下得到![]() ,可知B→
,可知B→![]() 引入氨基,A→B引入硝基,则B中Cl原子被氨基取代生成
引入氨基,A→B引入硝基,则B中Cl原子被氨基取代生成![]() ,可推知B为
,可推知B为![]() ,试剂a为浓硝酸、浓硫酸;
,试剂a为浓硝酸、浓硫酸;![]() 还原得到D为
还原得到D为![]() ;乙醇发生消去反应生成E为CH2=CH2,乙烯发生信息中加成反应生成F为
;乙醇发生消去反应生成E为CH2=CH2,乙烯发生信息中加成反应生成F为![]() ,W为芳香化合物,则X中也含有苯环,X发生氧化反应生成W,分子中均只含两种不同化学环境的氢原子,结合W的分子式,可知W为
,W为芳香化合物,则X中也含有苯环,X发生氧化反应生成W,分子中均只含两种不同化学环境的氢原子,结合W的分子式,可知W为![]() ,则X为
,则X为![]() ,W与D发生缩聚反应得到Y为
,W与D发生缩聚反应得到Y为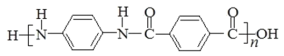 。
。
(6)CH2=CHCH=CH2和HC≡CH发生加成反应生成![]() ,
,![]() 和溴发生加成反应生成
和溴发生加成反应生成 ,
, 发生水解反应生成
发生水解反应生成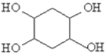 。
。
(1)生成 A是![]() ,可由苯与氯气发生取代反应生成氯苯,则反应类型是取代反应;
,可由苯与氯气发生取代反应生成氯苯,则反应类型是取代反应;
(2) A→B发生硝化反应,则试剂a是:浓硝酸、浓硫酸;
(3) B为![]() ,所含的官能团是:氯原子、硝基;
,所含的官能团是:氯原子、硝基;
(4) ①由分析知,F的结构简式是![]() ;
;
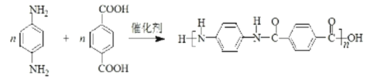
②![]() 和
和![]() 发生缩聚反应生成聚合物
发生缩聚反应生成聚合物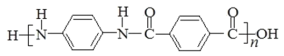 ,化学方程式是
,化学方程式是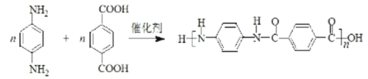 +(2n-1)H2O;
+(2n-1)H2O;
(5) Q是W(![]() )的同系物且相对分子质量比W大14,则Q含有苯环、2个羧基、比W多一个CH2原子团,有1个取代基为-CH(COOH)2;有2个取代基为-COOH、-CH2COOH,有邻、间、对3种;有3个取代基为2个-COOH与-CH3,2个-COOH有邻、间、对3种位置,对应的-CH3,分别有2种、3种、1种位置,故符合条件Q共有1+3+2+3+1=10种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的为
)的同系物且相对分子质量比W大14,则Q含有苯环、2个羧基、比W多一个CH2原子团,有1个取代基为-CH(COOH)2;有2个取代基为-COOH、-CH2COOH,有邻、间、对3种;有3个取代基为2个-COOH与-CH3,2个-COOH有邻、间、对3种位置,对应的-CH3,分别有2种、3种、1种位置,故符合条件Q共有1+3+2+3+1=10种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的为 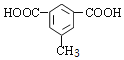 、
、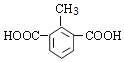 ;
;
(6) CH2=CHCH=CH2和HC≡CH发生加成反应生成![]() ,
,![]() 和溴发生加成反应生成
和溴发生加成反应生成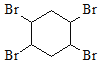 ,
, 发生水解反应生成
发生水解反应生成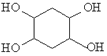 ,其合成路线为
,其合成路线为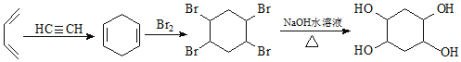 。
。


科目:高中化学 来源: 题型:
【题目】现欲用纯净的CaCO3与稀盐酸反应制取CO2,生成CO2的体积与时间的关系如图所示。下列叙述正确的是
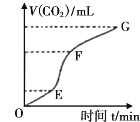
A.OE段化学反应速率最快
B.FG段收集的二氧化碳最多
C.由图像可推断出该反应为吸热反应
D.向溶液中加入氯化钠溶液,可以降低该反应的化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质](15分)A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是 (填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;A和B的氢化物所属的晶体类型分别为 和 。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为 ,中心原子的杂化轨道类型为 。
(4)化合物D2A的立体构型为 ,中心原子的价层电子对数为 ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm, F 的化学式为 :晶胞中A 原子的配位数为 ;列式计算晶体F的密度(g.cm-3) 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了为锂电池发展作出突出贡献的三位科学家。某废旧锂电池正极主要由LiFePO4、铝箔、炭黑等组成,Fe、Li、P具有极高的回收价值,具体流程如下:

(1)过程ⅰ生成NaAlO2溶液的离子方程式是__。
(2)过程ⅱ中HCl/H2O2的作用是__。
(3)浸出液X的主要成分为 Li+、Fe3+、H2PO4-等。过程ⅲ控制碳酸钠溶液浓度20%、温度85 ℃、反应时间3 h条件下,探究pH对磷酸铁沉淀的影响,如图所示。
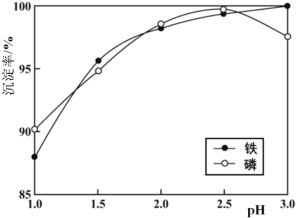
①综合考虑铁和磷沉淀率,最佳pH为__。
②结合平衡移动原理,解释过程ⅲ中pH增大,铁和磷沉淀率增大的原因__。
③当pH>2.5后,随pH增加,磷沉淀率出现了减小的趋势,解释其原因__。
(4)LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应制取,共沉淀反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知乙烯能发生以下转化:
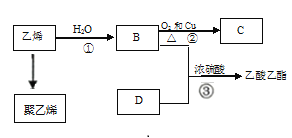
(1)写出化合物中的官能团的化学式或名称:B中所含官能团名称_;D中所含官能团化学式__;
(2)写出反应的化学方程式:
①_____________________, 反应类型:_____________;
②_____________________ , 反应类型:_____________;
③_____________________ , 反应类型:_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应M+Z→Q(△H<0)分两步进行:①M+Z→X(△H>0),②X→Q(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是
A.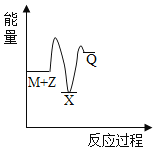 B.
B.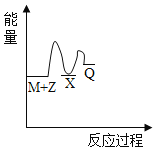
C.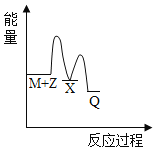 D.
D.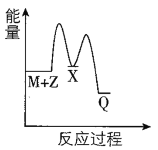
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流表指针 |
1 | Mg、Al | 稀盐酸 | 偏转 |
2 | Al、Cu | 稀盐酸 | 偏转 |
3 | Al、C(石墨) | 稀盐酸 | 偏转 |
4 | Mg、Al | 氢氧化钠溶液 | 偏转 |
5 | Al、Zn | 浓硝酸 | 偏转 |
下列回答错误的是
A.实验1、2中铝所作的电极(正极或负极)不相同
B.实验2、3,铝电极的电极反应式均为Al-3e-=Al3+
C.实验4中铝电极的电极反应式为Al-3e-+4OH-=![]() +2H2O
+2H2O
D.实验5中铝始终作原电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属及其化合物在生产、生活中应用广泛。
Ⅰ.CO2的有效利用可以缓解温室效应和能源短缺问题,CO2的分子结构决定了其性质和用途。
(1)CO2的电子式是______,包含的化学键类型为______共价键(填“非极性”或“极性”)。
(2)在温度高于31.26 oC、压强高于7.29×106 Pa时,CO2处于超临界状态,称为超临界CO2流体,可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,超临界CO2萃取的优点有______(答出一点即可)。
Ⅱ.氯水以及氯的化合物经常用于饮用水的消毒。
(3)将铁片插入盛有少量新制氯水的试管中,无气泡产生,用长滴管吸取KSCN溶液滴入铁片附近,溶液变红色,然后红色消失。显红色的离子方程式为______。
(4)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。
①优氯净中氯元素的化合价为___________。
②亚硫酸钠将水中多余次氯酸除去的反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.红褐色固体![]() 全部溶于氢碘酸:
全部溶于氢碘酸:![]()
B.水杨酸溶于![]() 溶液中:
溶液中:![]()
C.将等浓度的![]() 溶液与
溶液与![]() 液按体积比2:3混合:
液按体积比2:3混合:![]()
D.洁厕灵(含![]() )与84消毒液混合后产生氯气:
)与84消毒液混合后产生氯气:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com