
【题目】丙酮的碘代反应![]() 的速率方程为
的速率方程为![]() ,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为![]() 改变反应物浓度时,反应的瞬时速率如表所示。
改变反应物浓度时,反应的瞬时速率如表所示。
|
|
|
0.25 | 0.050 | 1.4 |
0.50 | 0.050 | 2.8 |
1.00 | 0.050 | 5.6 |
0.50 | 0.100 | 2.8 |
下列说法正确的是( )
A.速率方程中的![]() 、
、![]()
B.该反应的速率常数![]()
C.增大![]() 的浓度,反应的瞬时速率加快
的浓度,反应的瞬时速率加快
D.在过量的![]() 存在时,反应掉87.5%的
存在时,反应掉87.5%的![]() 所需的时间是375min
所需的时间是375min
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
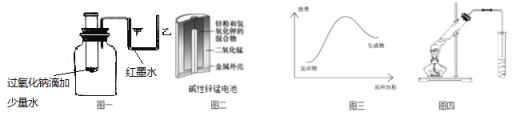
A.图一可表示模拟反应的能量变化,反应后左侧液面上升,右侧液面下降
B.图二所示电池中,MnO2的作用是催化剂
C.图三可表示需加热的放热反应
D.图四可用于乙酸和乙醇的酯化反应,小试管中是饱和碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
(1)滴定前排气泡时,应选择下图中的________(填序号)。
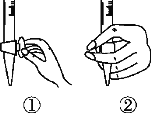
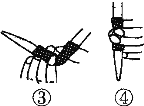
(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积______(填序号)。
①=10 mL ②=40 mL ③<10 mL ④>40 mL。
(3)上述滴定实验中,可选择_______为指示剂,选择该指示剂时如何判断反应到达滴定终点:______
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
实验① | 实验② | 实验③ |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
1mL0.01M的KMnO4溶液和1mL0.1M的H2C2O4溶液混合 |
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)![]() W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
A. B.
B.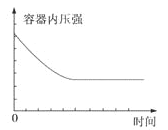
C.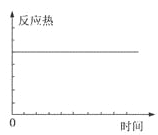 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
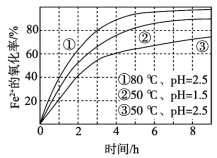
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
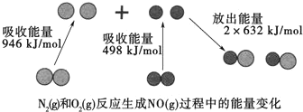
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会________(填“吸收”或“放出”)________kJ能量。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请将表中数据补充完整:a___________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。
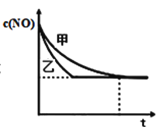
④在容积固定的容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数。下列说法正确的是( )
A. 1mol月球背面的氦—3(3He)含有质子为2NA
B. 标况下,22.4L甲烷和1molCl2反应后的混合物中含有氯原子数小于2NA
C. 2molSO2与1molO2充分反应,转移的电子数为4NA
D. 25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com