
【题目】在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)![]() W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
W(?)+4Q(g)△H<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是
A. B.
B.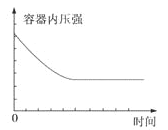
C.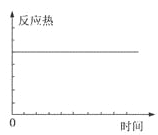 D.
D.
【答案】D
【解析】
A.当W为固体或液体时,随着反应的进行,气体质量越来越小,又由于容器的体积固定,所以密度应该越来越小;当W为气体时,质量一直不变,所以密度也一直不变,A错误;
B.由于反应是在恒容的密闭容器中进行,无论W的状态是气态、液态还是固态,该反应是气体体积增大的反应,随着反应的进行气体的物质的量逐渐增大,压强逐渐增大,当反应达到平衡时,压强不再增大,与反应事实不符合,B错误;
C.无论反应是否进行,也无论是否达到平衡状态,反应热都不会发生变化,故不能判断反应是否处于平衡状态,C错误;
D.由于该反应是气体体积增大的反应,所以随着反应的进行,气体分子数逐渐增多,当达到平衡时,气体分子数就不再发生变化,故可以判断反应处于平衡状态,D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:
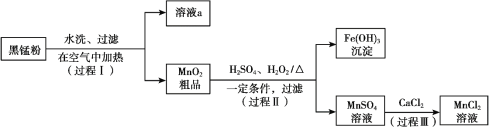
(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。
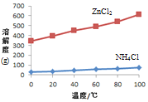
① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物![]() 的重要用途之一是生产汽车刹车片,其合成路线如图所示:
的重要用途之一是生产汽车刹车片,其合成路线如图所示:

已知:![]() +
+![]()
![]()
![]()
(1)A→B的反应类型属于_____________,D的名称是_____________,烃F的分子式为____________。
(2)E中含有官能团的名称是___________,C的结构简式为____________。
(3)用文字叙述淀粉转化为A的原理:___________。
(4)写出G→H的化学方程式:__________。
(5)烃F有多种同分异构体,写出其同分异构体中含有2个相同官能团且无支链的链状物质的结构简式:_____(任写三种),其中核磁共振氢谱峰最少的一种物质有______个峰。
(6)写出以2—甲基—1,3—丁二烯和丙烯为原料合成![]() 的合成路线:______(无机试剂任选)。
的合成路线:______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
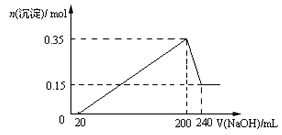
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.增大压强使平衡向生成Z的方向移动,平衡常数增大
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.反应达平衡时,X的转化率为50%
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙酮的碘代反应![]() 的速率方程为
的速率方程为![]() ,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为![]() 改变反应物浓度时,反应的瞬时速率如表所示。
改变反应物浓度时,反应的瞬时速率如表所示。
|
|
|
0.25 | 0.050 | 1.4 |
0.50 | 0.050 | 2.8 |
1.00 | 0.050 | 5.6 |
0.50 | 0.100 | 2.8 |
下列说法正确的是( )
A.速率方程中的![]() 、
、![]()
B.该反应的速率常数![]()
C.增大![]() 的浓度,反应的瞬时速率加快
的浓度,反应的瞬时速率加快
D.在过量的![]() 存在时,反应掉87.5%的
存在时,反应掉87.5%的![]() 所需的时间是375min
所需的时间是375min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某冶金行业产生的废渣(主要含![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)可以制备
等杂质)可以制备![]() ,生产流程如下:
,生产流程如下:
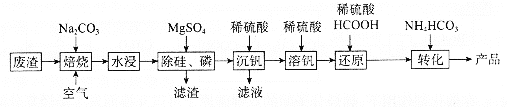
已知:![]() 微溶于水、溶于碱生成
微溶于水、溶于碱生成![]() (加热生成
(加热生成![]() ),具有强氧化性。向
),具有强氧化性。向![]() 溶液中加酸,不同
溶液中加酸,不同![]() 对应的主要存在形式如表:
对应的主要存在形式如表:
|
| 10.6~12 | 约8.4 | 3~8 | 约2 | <1 |
存在形式 |
|
|
|
|
|
|
回答下列问题:
(1)“焙烧”后V元素转化为![]() ,
,![]() 元素转化为________(写化学式)。
元素转化为________(写化学式)。
(2)欲除尽磷元素(即![]() ),最终溶液中
),最终溶液中![]() 的浓度至少为________
的浓度至少为________![]() (已知
(已知![]() )。
)。
(3)“沉钒”过程中,![]() 由8.5到5.0发生反应的离子方程式为________;最终需要控制
由8.5到5.0发生反应的离子方程式为________;最终需要控制![]() 约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
(4)“还原”和“转化”过程中主要反应的离子方程式分为________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是( )
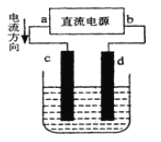
A.a为负极、b为正极
B.电解过程中,c电极上发生氧化反应
C.d为阳极,电极反应为:2Cl--2e-=Cl2↑
D.电解过程中,电能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com