
【题目】甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题。
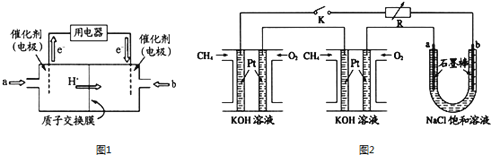
(1)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图1所示:通入b气体的电极是原电池的_________极(填“正”“负”),其电极反应式为_________________。
(2)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,U形管中氯化钠溶液的体积为800mL(氯化钠足量),且在电解过程中溶液体积变化忽略不计,产生的气体全部逸出,则在石墨电极a产生的气体为____________(填化学式),该气体在标况下的体积为___________。在电解后将U型管中溶液混合均匀,其pH为_______。
【答案】正 O2+4H+ + 4e-=2H2O Cl2 0.896L 13
【解析】
(1)由电子流动的方向可知,a为负极,b为正极,所以通入b气体的电极是原电池的正极。正极通入O2,O2得电子后,生成的O2-与溶液中的H+结合成H2O,其电极反应式为O2+4H+ + 4e-=2H2O;
(2)若每个电池甲烷用量均为0.224L(标况),即CH4为0.01mol,CH4中的C由-4价升高到+4价,所以1molCH4失去8mole-,共失电子0.08mol。石墨电极a与电源的正极相连,则其为阳极,产生的气体为Cl2,物质的量是0.08mol÷2=0.04mol,在标况下的体积是0.04mol×22.4L/mol=0.896L;根据方程式2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑可知生成氢氧化钠是0.08mol,则c(OH-)=
2NaOH+Cl2↑+H2↑可知生成氢氧化钠是0.08mol,则c(OH-)=![]() ,c(H+)=10-13mol/L,pH=13。
,c(H+)=10-13mol/L,pH=13。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42-)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为____。
A.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中
B.在搅拌下,将KClO饱和溶液缓慢滴加到Fe(NO3)3饱和溶液中
C.在搅拌下,将KClO饱和溶液和Fe(NO3)3饱和溶液一起加入
反应的离子方程式为______________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>____。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A物质是由茶叶中一种有机物衍变而来。已知:
①A物质氢原子核磁共振谱有6种。
②H结构简式为: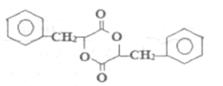
它们的关系如下:
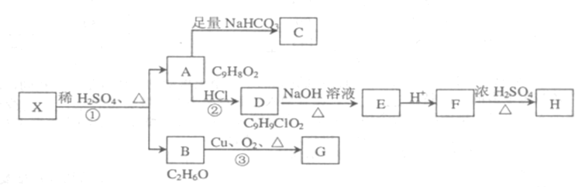
请回答下列问题:
(1)有机物X的结构简式为_______
(2)指出反应①、②、③的反应类型:①______② ______③______。
(3)写出下列反应的化学方程式(有机物写结构简式)
①D—E:_____________
②F在浓硫酸加热条件下发生缩聚反应的化学方程式:____________
(4)写出所有符合下列条件的A的同分异构体的结构简式:__________
①苯环上只有一个取代基
②能发生水解反应
③能与银氨溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述中正确的是

A. 用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液
B. 装置②的总反应式:Cu + 2Fe3+ = Cu2+ + 2Fe2+
C. 装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
D. 装置④中插入海水中的铁棒,越靠近底端腐蚀越严重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机物。某化学兴趣小组对乙酸乙酯的制取进行探究活动。
[查阅资料]乙酸乙酯:无色、有芬芳气味的液体,沸点77℃,熔点-83.6℃,密度0.901g/cm3,溶于乙醇、氯仿、乙醚和苯等,微溶于水,在饱和碳酸钠中溶液溶解度更小,比水轻。

[反应原理]
CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
[实验探究]某化学兴趣小组设计如图装置进行实验。在大试管a内加入碎瓷片后,加入10mL乙醇,边振荡边加入5mL98%的浓H2SO4,冷却后再加入8mL冰醋酸,点燃酒精灯缓慢加热,将产生的蒸气经导管通入到试管b中的的饱和Na2CO3溶液的液面上,观察现象。
[问题讨论]
(1)试管a内加入碎瓷片的作用_______(填“防止暴沸”或“防止倒吸”);
(2)试管b中长导管没有伸入饱和Na2CO3溶液的原因是_______(填“防止暴沸”或“防止倒吸”);
(3)实验中饱和碳酸钠溶液的作用是_______________;
A.中和乙酸和乙醇
B.加速酯的生成,提高其产率
C.溶解乙醇,中和乙酸,降低乙酸乙酯的溶解,有利于分层析出。
(4)反应结束后试管b中的现象是_______;
A.溶液不分层
B.溶液分层,无色油状液体在上层
C.溶液分层,无色油状液体在下层
(5)若用9.2g乙醇与足量的冰醋酸反应,分离得到纯乙酸乙酯13.2g,反应的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Al2(SO4)3溶液加热蒸干并灼烧最终得到物质是________________(填化学式),将NaHCO3与Al2(SO4)3两者溶液混合后可做泡沫灭火剂,其原理是_____________________(用离子方程式表示)
(2)实验室溶液中常用NaOH来进行洗气和提纯。当100mL 1mol·L-1的NaOH溶液吸收标准状况下2.24LSO2时,所得溶液中各离子浓度由大到小的顺序为____________________________
(3)25℃时,几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,_____先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为____(KspCu(OH)2=1×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾 CuSO4·5H2O 可写[Cu(H2O)4]SO4·H2O,其结构示意图如图:
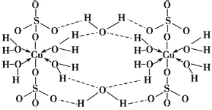
下列有关胆矾的说法正确的是( )
A.Cu2+的电子排布式为[Ar]3d84s1
B.胆矾是分子晶体,分子间存在氢键
C.氧原子参与形成离子键、配位键和氢键三种化学键
D.因为作用力的不同,胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z在周期表中的位置如图。下列说法正确的是
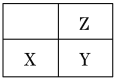
A. Z元素的最高化合价一定大于X元素
B. 三种元素原子半径由高到低的顺序一定是Y>X>Z
C. 若它们的原子最外层电子数之和为11,则X为金属元素
D. 若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(气)+B(气)![]() 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
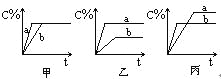
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则______曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_________热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则________曲线是表示压强较大的情况。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com