
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42-)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为____。
A.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中
B.在搅拌下,将KClO饱和溶液缓慢滴加到Fe(NO3)3饱和溶液中
C.在搅拌下,将KClO饱和溶液和Fe(NO3)3饱和溶液一起加入
反应的离子方程式为______________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>____。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)______________________。
【答案】A 3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O 3 Fe4(OH)2(SO4)5
【解析】
(1)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
(2)当Fe3+完全沉淀时,c(Fe3+)<10-5mol/L,则该溶液中c(OH-)=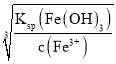 ,然后根据水的离子积常数计算溶液中c(H+);
,然后根据水的离子积常数计算溶液中c(H+);
(3)根据S元素守恒,可由BaSO4沉淀的质量计算20.00 mL溶液中:n(SO42-)=n(BaSO4),再根据:5Fe3+~5Fe2+~MnO4-,计算n(Fe3+);由电荷守恒:3n(Fe3+)=2n(SO42-)+n(OH-)计算n(OH-),进而计算n(Fe3+):n(OH-):n(SO42-),可确定化学式。
(1)制备K2FeO4时,KClO饱和溶液与Fe(NO3)3溶液的混合方式为:将Fe(NO3)3溶液慢慢滴入KClO溶液中,根据电荷守恒、电子守恒、原子守恒,可得该反应的离子方程式是3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(2)当Fe3+完全沉淀时,c(Fe3+)<1.0×10-5mol/L,则该溶液中c(OH-)=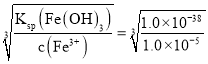 =1.0×10-11mol/L,则根据室温下水的离子积常数Kw=1.0×10-14mol2/L2可知溶液中 c(H+)=
=1.0×10-11mol/L,则根据室温下水的离子积常数Kw=1.0×10-14mol2/L2可知溶液中 c(H+)=![]() mol/L=1.0×10-3mol/L,所以溶液的pH=3;
mol/L=1.0×10-3mol/L,所以溶液的pH=3;
(3)20.00 mL溶液中:n(SO42-)=n(BaSO4)=![]() =0.0500 mol,根据电子守恒可得关系式:5Fe3+~5Fe2+~MnO4-,n(Fe3+)=5n(MnO4-)=5×0.100 0 mol/L×8.00×10-3 L×
=0.0500 mol,根据电子守恒可得关系式:5Fe3+~5Fe2+~MnO4-,n(Fe3+)=5n(MnO4-)=5×0.100 0 mol/L×8.00×10-3 L×![]() =0.0400 mol,由电荷守恒:3n(Fe3+)=2n(SO42-)+n(OH-),n(OH-)=3n(Fe3+)-2n(SO42-)=3×0.0400mol-2×0.0500mol=0.0200mol,所以n(Fe3+):n(OH-):n(SO42-)=0.0400mol:0.0200mol:0.0500mol=4:2:5,所以该聚合硫酸铁的化学式为Fe4(OH)2(SO4)5。
=0.0400 mol,由电荷守恒:3n(Fe3+)=2n(SO42-)+n(OH-),n(OH-)=3n(Fe3+)-2n(SO42-)=3×0.0400mol-2×0.0500mol=0.0200mol,所以n(Fe3+):n(OH-):n(SO42-)=0.0400mol:0.0200mol:0.0500mol=4:2:5,所以该聚合硫酸铁的化学式为Fe4(OH)2(SO4)5。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
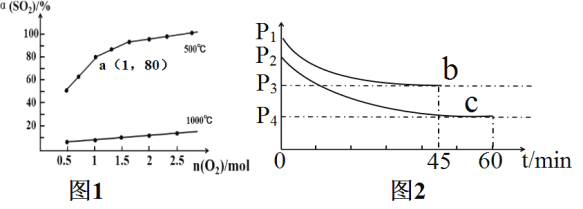
【题目】催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
已知反应aA(g)+bB(g)![]() gG(g)+hH(g)的标准平衡常数Kθ=
gG(g)+hH(g)的标准平衡常数Kθ= ,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
(1)在绝热恒容的密闭容器中,能表明反应2SO2(g)+O2(g)![]() 2SO3(g)已达到平衡状态的是___。
2SO3(g)已达到平衡状态的是___。
A.v(SO2)=2v(O2)
B.当容器内温度不再变化时
C.各组分的物质的量相等
D.容器内气体密度不变
E.混合气体的平均相对分子质量不变
(2)在1000℃时随着O2物质的量的增大,但SO2平衡转化率升高缓慢,其原因是___。
(3)求图1中a点的标准平衡常数Kθ=___。在a点达到平衡后,若保持温度、压强不变,再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,此时v(正)___v(逆)(填“<”“>”或“=”)。
(4)若在相同的恒容密闭容器中充入O2和SO2各2mol,在不同温度下达到平衡,反应体系总压强随时间变化如图2所示,则达到平衡状态b和c时,SO3体积分数较大的是___(填“b”或“c”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示______、______,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________;
(2)图中△H=__KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H__(要求写计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中![]() 与
与![]() 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是![]()
![]()
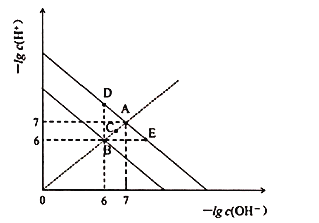
A.图中五点![]() 间的关系:
间的关系:![]()
B.![]() 点对应的水溶液中,可能有
点对应的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同时存在
大量同时存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 与
与![]() 关系如图D点所示,则溶液中有:
关系如图D点所示,则溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,当
溶液,当![]() 与
与![]() 关系如图E点所示,则溶液中反应:
关系如图E点所示,则溶液中反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮是水体中氮的主要形态之一,氨氮含量过高对水中生物会构成安全威胁。
(1)一定条件下,水中的氨氮可以转化为氮气而除去。
已知:2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1
2NO2-(aq)+O2(g)=2NO3-(aq) ΔH=b kJ·mol-1
5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1
则4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) ΔH=________kJ·mol-1。
(2)实验室用电解法模拟处理氨氮废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图所示。增大氯离子浓度可使氨氮去除率____(填“增大”、“减小”或“不变”),其原因是阳极生成强氧化性气体,则阳极电极反应为_______。

(3)化学沉淀法是一种处理高浓度氨氮废水的有效方法。通过加入MgCl2和Na2HPO4将NH4+转化为MgNH4PO4·6H2O沉淀除去。25 ℃时,在氨氮初始质量浓度400 mg·L-1、n(Mg)∶n(P)∶n(N)=1∶1∶1的条件下,溶液pH对氨氮去除率及剩余氨氮浓度和总磷浓度的影响如图所示。
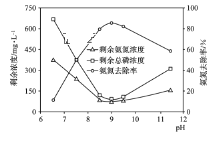
①反应生成MgNH4PO4·6H2O沉淀的离子方程式为______________。
②该实验条件下,控制溶液的适宜pH范围为________;当pH>9时,溶液中总磷浓度随pH增大而增大的主要原因是_________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B.电镀时,通常把待镀金属制品作阳极,镀层金属作阴极
C.常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的ΔH>0
D.工业通过反应“Na(l)+KCl(l)![]() NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脑白金的主要成分的结构简式如图:
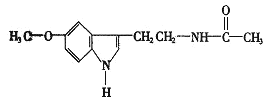
下列对脑白金主要成分的推论错误的是( )
A.其分子式为C13H16N2O2
B.能水解生成乙酸
C.能与溴水发生加成反应
D.其营养成分及官能团与葡萄糖相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和甲醇可以做燃料电池,具有广阔的开发和应用前景,回答下列问题。
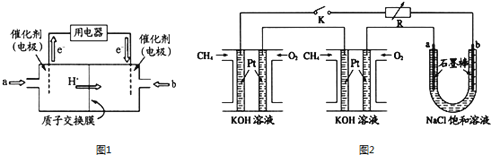
(1)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图1所示:通入b气体的电极是原电池的_________极(填“正”“负”),其电极反应式为_________________。
(2)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图2所示。闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,U形管中氯化钠溶液的体积为800mL(氯化钠足量),且在电解过程中溶液体积变化忽略不计,产生的气体全部逸出,则在石墨电极a产生的气体为____________(填化学式),该气体在标况下的体积为___________。在电解后将U型管中溶液混合均匀,其pH为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com