
【题目】在不同温度下,水溶液中![]() 与
与![]() 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是![]()
![]()
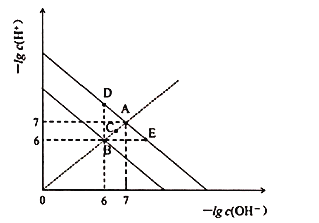
A.图中五点![]() 间的关系:
间的关系:![]()
B.![]() 点对应的水溶液中,可能有
点对应的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同时存在
大量同时存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 与
与![]() 关系如图D点所示,则溶液中有:
关系如图D点所示,则溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,当
溶液,当![]() 与
与![]() 关系如图E点所示,则溶液中反应:
关系如图E点所示,则溶液中反应:![]()
【答案】C
【解析】
由图象可知,A、E、D都为![]() 时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液,据此分析解答。
时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,水的离子积只与温度有关,与溶液的类型无关,可能为纯水,也可能为酸、碱、盐溶液,据此分析解答。
A.由图象可知,A、E、D都为![]() 时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则
时的曲线上,水的Kw只与温度有关,温度相同时Kw相同,温度升高,促进水的电离,Kw增大,则![]() ,由C点
,由C点![]() 可知,C点的Kw大于A点小于B,所以
可知,C点的Kw大于A点小于B,所以![]() ,故A正确;
,故A正确;
B.E点![]() ,溶液呈酸性,酸性条件下,
,溶液呈酸性,酸性条件下,![]() 、
、![]() 、
、![]() 、
、![]() 没有沉淀、气体、弱电解质、氧化还原反应产生,所以能共存,故B正确;
没有沉淀、气体、弱电解质、氧化还原反应产生,所以能共存,故B正确;
C.D点溶液中![]() ,溶液呈碱性,说明
,溶液呈碱性,说明![]() 的水解程度大于电离程度,所以
的水解程度大于电离程度,所以![]() ,故C错误;
,故C错误;
D.E点![]() ,溶液呈酸性,向
,溶液呈酸性,向![]() 溶液中滴入
溶液中滴入![]() 溶液,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
溶液,则溶液中反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题。
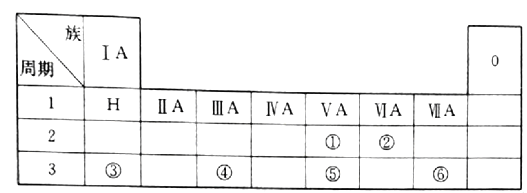
(1)② 表示的元素是______(填元素符号);
(2)①、⑤两种元素的原子半径大小为②______⑤(填“< ”或“>”);
(3)⑤所在元素周期表中的位置是_____________;
(4)写出③与⑥两种元素所形成化合物的化学式_________;
(5)④所表示元素的单质与③所表示元素的最高价氧化物的水化物在溶液中反应的离子方程式为:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________。
(2)该反应为______反应(选填吸热、放热)。
升高温度CO2的转化将____________(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是______(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4 ③0.1mol/LNH4HSO4④0.1mol/L NH3H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3H2O。
请根据要求填写下列空白:
(1)溶液①呈_____性(填“酸”、“碱”或“中”),其原因是________(用离子方程式表示)。
(2)比较②③溶液中,c(NH4+)的大小关系是②______③(填“>”“<”或“=”)。
(3)在溶液④中,_____ 离子的浓度为0.1mol/L;NH3H2O和_____离子的物质的量浓度之和为0.2mol/L。
(4)室温下,测得溶液②的pH=7,则CH3COO-的水解程度_____(填“>”“<”或“=”)NH4+-的水解程度。CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42-)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为____。
A.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中
B.在搅拌下,将KClO饱和溶液缓慢滴加到Fe(NO3)3饱和溶液中
C.在搅拌下,将KClO饱和溶液和Fe(NO3)3饱和溶液一起加入
反应的离子方程式为______________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>____。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
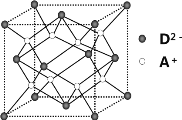
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为__________,在CB3分子中C元素原子的原子轨道发生的是__________杂化。
(2)C的氢化物的空间构型为__________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________。
(3)B元素的电负性__________D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:__________。
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为__________。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述中正确的是

A. 用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液
B. 装置②的总反应式:Cu + 2Fe3+ = Cu2+ + 2Fe2+
C. 装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
D. 装置④中插入海水中的铁棒,越靠近底端腐蚀越严重
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com