
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为__________,在CB3分子中C元素原子的原子轨道发生的是__________杂化。
(2)C的氢化物的空间构型为__________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________。
(3)B元素的电负性__________D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:__________。
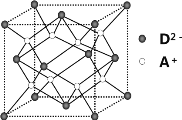
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为__________。(阿伏加德罗常数用NA表示)
【答案】ls22s22p63s23p6或者[Ne]3s23p6 sp3 三角锥形 氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高 > Cl2+Na2S=2NaCl+S↓ ![]() g·
g·![]()
【解析】
B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B-离子为Cl-离子,A+比B-少一个电子层,A+为Na+离子;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为 40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素,A+是Na+离子,D2-离子是S2-离子,R是由Na+离子与S2-离子以2:1形成的离子化合物,R是硫化钠。
(1)B离子为Cl离子,电子排布式为ls22s22p63s23p6或者[Ne]3s23p6;CB3分子为NCl3分子,N原子有一对孤对电子,与Cl原子成3个δ键,杂化轨道数为1+3=4,所以为sp3杂化。故答案为:ls22s22p63s23p6或者[Ne]3s23p6;sp3。
(2)C的氢化物为NH3,N原子采取sp3杂化,N原子有一对孤对电子,所以NH3为三角锥形,N原子电负性很强,氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高。故答案为:三角锥形;氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高。
(4)B为Cl元素,D为S元素,同周期,自左而右,电负性增强,所以电负性Cl>S.利用“在氧化还原反应中,氧化剂氧化性大于氧化产物”原理,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在Cl2+Na2S=2NaCl+S↓反应中,Cl2的氧化性大于O2的氧化性。故答案为:>;Cl2+Na2S=2NaCl+S↓;
(5)A+是Na+离子,D2离子是S2离子,根据均摊法计算,晶胞含有S2离子个数8×![]() +6×
+6×![]() =4,含有A+是Na+离子8个,即一个晶胞含有4个硫化钠分子,所以密度为
=4,含有A+是Na+离子8个,即一个晶胞含有4个硫化钠分子,所以密度为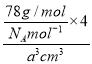 =
=![]() g·
g·![]() 。
。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】已知阿司匹林(![]() )是一种常见药物,其中一种合成路线:
)是一种常见药物,其中一种合成路线:
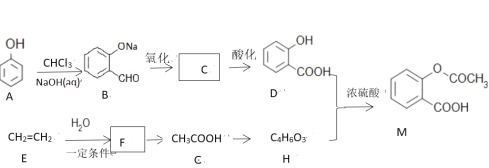
已知:酸酐更易与醇或酚发生酯化反应,已知甲酸酐为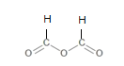
(1)写出M所含官能团名称:______________,E生成F的反应类型为:________________。
(2)写出物质B与银氨溶液的反应方程式:___________________。
(3)物质A生成B的过程中还有可能生成另一种苯环的二取代产物为:___________。
(4)物质B到D先氧化后酸化的原因是:_________________,符合下列条件D的同分异构体有多少种:_________。
a.遇到FeCl3会显紫色 b.可以发生银镜反应
(5)写出D+H→M的反应方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中![]() 与
与![]() 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是![]()
![]()
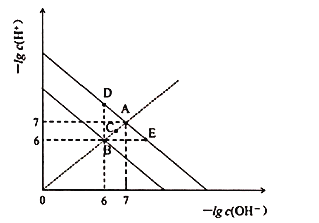
A.图中五点![]() 间的关系:
间的关系:![]()
B.![]() 点对应的水溶液中,可能有
点对应的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同时存在
大量同时存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 与
与![]() 关系如图D点所示,则溶液中有:
关系如图D点所示,则溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,当
溶液,当![]() 与
与![]() 关系如图E点所示,则溶液中反应:
关系如图E点所示,则溶液中反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B.电镀时,通常把待镀金属制品作阳极,镀层金属作阴极
C.常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的ΔH>0
D.工业通过反应“Na(l)+KCl(l)![]() NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脑白金的主要成分的结构简式如图:
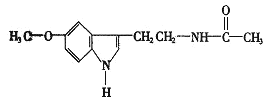
下列对脑白金主要成分的推论错误的是( )
A.其分子式为C13H16N2O2
B.能水解生成乙酸
C.能与溴水发生加成反应
D.其营养成分及官能团与葡萄糖相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
B.室温下,将![]() HA溶液和
HA溶液和![]() 溶液等体积混合
溶液等体积混合![]() 忽略体积的变化
忽略体积的变化![]() 测得混合溶液的
测得混合溶液的![]() ,则混合溶液中由水电离出的
,则混合溶液中由水电离出的![]()
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于![]() 时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]()
![]() 的
的![]() 溶液和
溶液和![]()
![]()
![]() 溶液混合后会有
溶液混合后会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中加入400 mL 0.01 mol·L-1Na2SO4溶液,下列叙述正确的是
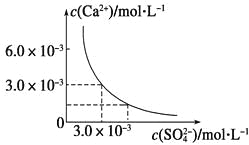
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,下列古代文献中充分记载了古代化学研究成果,对其说明不合理的是
选项 | 古代文献 | 说明 |
A. |
| 陶是一种传统硅酸盐材料 |
B. | 李白诗句“日照香炉生紫烟,遥看瀑布挂前川” | 诗中未涉及化学变化 |
C. |
| 文中涉及的操作方法有溶解、萃取、过滤 |
D. |
| 冰的能量低于水,冰转化为水属于吸热反应 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com