
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题。
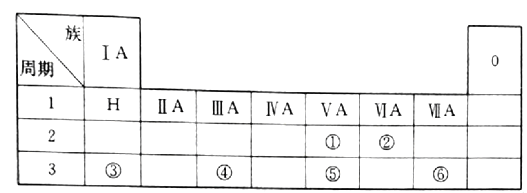
(1)② 表示的元素是______(填元素符号);
(2)①、⑤两种元素的原子半径大小为②______⑤(填“< ”或“>”);
(3)⑤所在元素周期表中的位置是_____________;
(4)写出③与⑥两种元素所形成化合物的化学式_________;
(5)④所表示元素的单质与③所表示元素的最高价氧化物的水化物在溶液中反应的离子方程式为:________________________________________________________。
【答案】O < 第三周期第VA族 NaCl ![]()
【解析】
由元素在周期表中所在位置可以推出,①为N,②为O,③为Na,④为Al,⑤为P,
⑥为Cl。
(1)② 表示的元素是O。答案为:O
(2)①、⑤两种元素为N和P,二者是同主族元素,P比N多一个电子层,原子半径大小为②< ⑤。答案为:<
(3)⑤为P,它所在元素周期表中的位置是第三周期第VA族。
答案为:第三周期第VA族
(4)③与⑥两种元素分别为Na和Cl,二者所形成化合物的化学式为NaCl。
答案为:NaCl
(5)④所表示元素的单质Al与③所表示元素的最高价氧化物的水化物NaOH在溶液中反应的离子方程式为2Al+2OH-+2H2O=2A1O2-+3H2↑。
答案为:2Al+2OH-+2H2O=2A1O2-+3H2↑


科目:高中化学 来源: 题型:
【题目】A、B、C、X和Y均为中学常见物质,其中A、B、C为单质,X、Y为化合物,各物质之间的转化关系如图所示![]() 部分反应条件略去
部分反应条件略去![]() .
.

![]() 若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
若X是光导纤维的主要成分,工业上常利用反应Ⅰ制备B,Y的化学式为 ____,B的其中一种用途为 ______ .
![]() 若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
若A、B为生活中常见的两种金属单质,X是一种黑色磁性物质.X与氢碘酸反应的离子方程式为 ______ .
![]() 若组成A的元素在短周期中原子半径最大
若组成A的元素在短周期中原子半径最大![]() 稀有气体除外
稀有气体除外![]() ,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______
,以Y为电解质溶液,气体B为燃料,C为氧化剂可构成碱性燃料电池,其负极反应式为 ______ ,工作一段时间后,Y溶液的pH ______ ![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() .
.
![]() 若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
若常温下A、B、C和X均为气体,Y为固体,管道工人曾利用反应Ⅰ检验氯气管道是否漏气.
![]() 的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
的电子式为 ______ ,反应Ⅰ的化学方程式为 ______ .
![]() 将
将![]() 的X溶液与
的X溶液与![]() 的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
的Y溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有![]() ,光照下,草酸
,光照下,草酸![]() 能将其中的
能将其中的![]() 转化为
转化为![]() 某课题组研究发现,少量铁明矾
某课题组研究发现,少量铁明矾![]() 即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
探究如下:在![]() 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
实验编号 | 初始pH | 废水样品体积 | 草酸溶液体积 | 蒸馏水体积 |
| 4 | 60 | 10 | 30 |
| 5 | 60 | 10 | 30 |
| 5 | 60 | 15 | 25 |
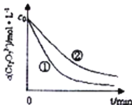
测得实验![]() 和
和![]() 溶液中的
溶液中的![]() 随时间变化关系如图所示.
随时间变化关系如图所示.
(1)实验![]() 和
和![]() 的结果表明 ______ .
的结果表明 ______ .
(2)根据实验![]() 和
和![]() ,画出实验
,画出实验![]() 中
中![]() 随时间变化的趋势图._____________
随时间变化的趋势图._____________
(3)该课题组对铁明矾![]() 中起催化作用的成分提出如下假设,请你完成假设二和假设三:
中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:![]() 起催化作用;
起催化作用;
假设二: ______ ;
假设三: ______ ;
![]()
(4)设计实验验证上述假设一,可选用下列物质代替少量铁明矾![]()
的是 ______ ![]()
![]()
![]() ,
,![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题:
(l)食品和药物安全是国家高度重视的民生问题。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择_______;
②是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是_______;
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是_______。
(2)钢铁是目前用量最大、用途最广的合金材料,在潮湿空气中容易发生腐蚀。请写出钢铁发生电化学腐蚀的负极反应式_______________________________________。
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料, 生活中的玻璃、陶瓷、水泥属于上述材料中的______________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式或离子方程式正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.实验室用液溴和苯在催化剂作用下制溴苯:![]() + Br2
+ Br2![]()
![]() +HBr
+HBr
C.实验室用乙醇制乙烯:CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
D.少量苯酚与浓溴水的反应:![]() +3Br2
+3Br2![]()
 ↓+3HBr
↓+3HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
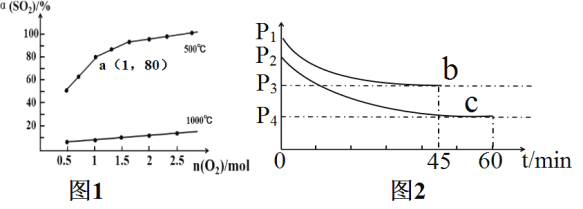
【题目】催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
已知反应aA(g)+bB(g)![]() gG(g)+hH(g)的标准平衡常数Kθ=
gG(g)+hH(g)的标准平衡常数Kθ= ,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
(1)在绝热恒容的密闭容器中,能表明反应2SO2(g)+O2(g)![]() 2SO3(g)已达到平衡状态的是___。
2SO3(g)已达到平衡状态的是___。
A.v(SO2)=2v(O2)
B.当容器内温度不再变化时
C.各组分的物质的量相等
D.容器内气体密度不变
E.混合气体的平均相对分子质量不变
(2)在1000℃时随着O2物质的量的增大,但SO2平衡转化率升高缓慢,其原因是___。
(3)求图1中a点的标准平衡常数Kθ=___。在a点达到平衡后,若保持温度、压强不变,再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,此时v(正)___v(逆)(填“<”“>”或“=”)。
(4)若在相同的恒容密闭容器中充入O2和SO2各2mol,在不同温度下达到平衡,反应体系总压强随时间变化如图2所示,则达到平衡状态b和c时,SO3体积分数较大的是___(填“b”或“c”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿司匹林(![]() )是一种常见药物,其中一种合成路线:
)是一种常见药物,其中一种合成路线:
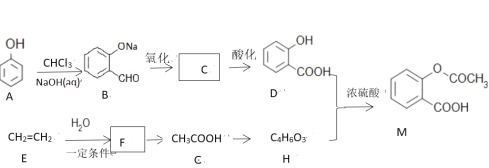
已知:酸酐更易与醇或酚发生酯化反应,已知甲酸酐为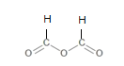
(1)写出M所含官能团名称:______________,E生成F的反应类型为:________________。
(2)写出物质B与银氨溶液的反应方程式:___________________。
(3)物质A生成B的过程中还有可能生成另一种苯环的二取代产物为:___________。
(4)物质B到D先氧化后酸化的原因是:_________________,符合下列条件D的同分异构体有多少种:_________。
a.遇到FeCl3会显紫色 b.可以发生银镜反应
(5)写出D+H→M的反应方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中![]() 与
与![]() 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是![]()
![]()
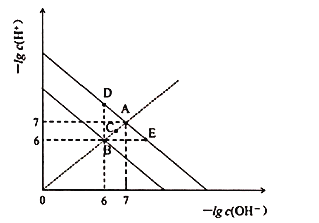
A.图中五点![]() 间的关系:
间的关系:![]()
B.![]() 点对应的水溶液中,可能有
点对应的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同时存在
大量同时存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 与
与![]() 关系如图D点所示,则溶液中有:
关系如图D点所示,则溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,当
溶液,当![]() 与
与![]() 关系如图E点所示,则溶液中反应:
关系如图E点所示,则溶液中反应:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com