
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________。
(2)该反应为______反应(选填吸热、放热)。
升高温度CO2的转化将____________(填增大、减小或不变)。
(3)能判断该反应是否达到化学平衡状态的依据是______(多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
【答案】K= C(CO)·C(H2O)/[C(CO2)·C(H2)] 吸热反应 增大 BC 830℃
【解析】
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,实验根据反应的方程式可知,该反应的化学平衡常数表达式为K=C(CO)·C(H2O)/[C(CO2)·C(H2)]。
(2)随着温度的升高,平衡常数逐渐增大,这说明升高温度平衡向正反应方向进行,则正方应是吸热反应。升高温度CO2的转化将增大。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以b正确。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,d不能说明。该反应是体积不变的可逆反应,则压强始终是不变的,a不能说明。C中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明,答案选bc。
(4)根据平衡常数的表达式可知,c(CO2)·c(H2)=c(CO)·c(H2O)是K=1,所以根据表中数据可知此时的温度为830℃。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有![]() ,光照下,草酸
,光照下,草酸![]() 能将其中的
能将其中的![]() 转化为
转化为![]() 某课题组研究发现,少量铁明矾
某课题组研究发现,少量铁明矾![]() 即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
探究如下:在![]() 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
实验编号 | 初始pH | 废水样品体积 | 草酸溶液体积 | 蒸馏水体积 |
| 4 | 60 | 10 | 30 |
| 5 | 60 | 10 | 30 |
| 5 | 60 | 15 | 25 |
测得实验![]() 和
和![]() 溶液中的
溶液中的![]() 随时间变化关系如图所示.
随时间变化关系如图所示.
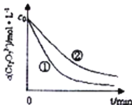
(1)实验![]() 和
和![]() 的结果表明 ______ .
的结果表明 ______ .
(2)根据实验![]() 和
和![]() ,画出实验
,画出实验![]() 中
中![]() 随时间变化的趋势图._____________
随时间变化的趋势图._____________
(3)该课题组对铁明矾![]() 中起催化作用的成分提出如下假设,请你完成假设二和假设三:
中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:![]() 起催化作用;
起催化作用;
假设二: ______ ;
假设三: ______ ;
![]()
(4)设计实验验证上述假设一,可选用下列物质代替少量铁明矾![]()
的是 ______ ![]()
![]()
![]() ,
,![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
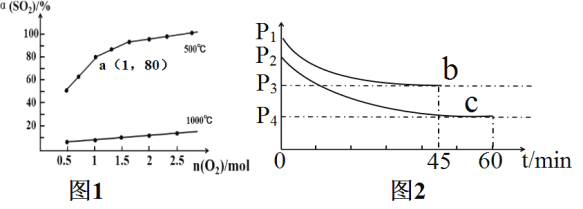
【题目】催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
已知反应aA(g)+bB(g)![]() gG(g)+hH(g)的标准平衡常数Kθ=
gG(g)+hH(g)的标准平衡常数Kθ= ,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
(1)在绝热恒容的密闭容器中,能表明反应2SO2(g)+O2(g)![]() 2SO3(g)已达到平衡状态的是___。
2SO3(g)已达到平衡状态的是___。
A.v(SO2)=2v(O2)
B.当容器内温度不再变化时
C.各组分的物质的量相等
D.容器内气体密度不变
E.混合气体的平均相对分子质量不变
(2)在1000℃时随着O2物质的量的增大,但SO2平衡转化率升高缓慢,其原因是___。
(3)求图1中a点的标准平衡常数Kθ=___。在a点达到平衡后,若保持温度、压强不变,再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,此时v(正)___v(逆)(填“<”“>”或“=”)。
(4)若在相同的恒容密闭容器中充入O2和SO2各2mol,在不同温度下达到平衡,反应体系总压强随时间变化如图2所示,则达到平衡状态b和c时,SO3体积分数较大的是___(填“b”或“c”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
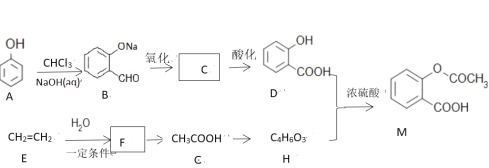
【题目】已知阿司匹林(![]() )是一种常见药物,其中一种合成路线:
)是一种常见药物,其中一种合成路线:
已知:酸酐更易与醇或酚发生酯化反应,已知甲酸酐为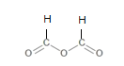
(1)写出M所含官能团名称:______________,E生成F的反应类型为:________________。
(2)写出物质B与银氨溶液的反应方程式:___________________。
(3)物质A生成B的过程中还有可能生成另一种苯环的二取代产物为:___________。
(4)物质B到D先氧化后酸化的原因是:_________________,符合下列条件D的同分异构体有多少种:_________。
a.遇到FeCl3会显紫色 b.可以发生银镜反应
(5)写出D+H→M的反应方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
(1)用离子方程式说明钡餐透视时为什么不用BaCO3?____________________________________________。
(2)某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:① 5 mL水② 20 mL 0.5 mol·L-1的Na2SO4溶液③ 40 mL 0.2mol·L-1的Ba(OH)2溶液④ 40 mL 0.1 mol·L-1的H2SO4溶液中,溶解至饱和以上各溶液中,c(Ba2+)的大小顺序正确的是________,BaSO4的溶解度的大小顺序为______________
A.③ >① >④ >② B.③ >① >② >④ C.① >④ >③ >② D.① >③ >④ >②
(3)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(SO42-)为 ______________,溶液②中c(Ba2+)为 __________________。
(4)取溶液③和溶液④直接混合,则混合溶液的pH为 __________ (假设混合后溶液的体积为混合前两溶液的体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示______、______,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________;
(2)图中△H=__KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H__(要求写计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水溶液中![]() 与
与![]() 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是![]()
![]()
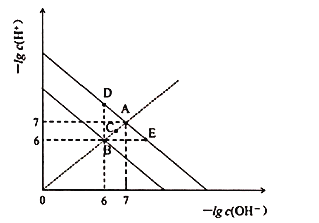
A.图中五点![]() 间的关系:
间的关系:![]()
B.![]() 点对应的水溶液中,可能有
点对应的水溶液中,可能有![]() 、
、![]() 、
、![]() 、
、![]() 大量同时存在
大量同时存在
C.若![]() 的NaHA溶液水溶液中
的NaHA溶液水溶液中![]() 与
与![]() 关系如图D点所示,则溶液中有:
关系如图D点所示,则溶液中有:![]()
D.向![]() 溶液中滴入
溶液中滴入![]() 溶液,当
溶液,当![]() 与
与![]() 关系如图E点所示,则溶液中反应:
关系如图E点所示,则溶液中反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com