
����Ŀ���о�NO2��SO2 ��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ__________________��
���÷�Ӧ6NO2��8NH3 ![]() 7N2��12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������_________ L��
7N2��12H2OҲ�ɴ���NO2����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������_________ L��
��2����֪��2SO2(g)+O2(g)![]() 2SO3(g) ��H����196.6 kJ��mol-1
2SO3(g) ��H����196.6 kJ��mol-1
2NO(g)+O2(g)![]() 2NO2(g) ��H����113.0 kJ��mol-1
2NO2(g) ��H����113.0 kJ��mol-1
��ӦNO2(g)+SO2(g)![]() SO3(g)+NO(g) �Ħ�H��__________kJ��mol-1��
SO3(g)+NO(g) �Ħ�H��__________kJ��mol-1��
һ�������£���NO2��SO2�������1:2����һ�����ܱվ��������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����________��
a����ϵѹǿ���ֲ��䡡�������������� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��䡡���� d��ÿ����1 mol SO3��ͬʱ����1 mol NO2
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)+2H2(g)![]() CH3OH(g) ��H����a kJ��mol-1��
CH3OH(g) ��H����a kJ��mol-1��
��һ���¶��£���1mol CO(g)��2molH2(g)���뵽���Ϊ10L���ܱ������У�������Ӧ������5min�ﵽƽ�⣬��ʱ������ѹǿΪ��Ӧǰ��0.8�������ʱv����CH3OH��Ϊ_____������Ӧ�ų�������Ϊ__________________��
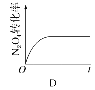
��4����֪N2O4(g) ![]() 2NO2(g)����H��0���ֽ�1molN2O4����һ��ѹ�ܱ������У�����ʾ��ͼ����˵����Ӧ�ﵽƽ��״̬����________��
2NO2(g)����H��0���ֽ�1molN2O4����һ��ѹ�ܱ������У�����ʾ��ͼ����˵����Ӧ�ﵽƽ��״̬����________��



���𰸡� 3NO2+H2O![]() 2HNO3+NO 6.72 ��41.8 b 0.006mol/(L��min) 0.3a kJ B
2HNO3+NO 6.72 ��41.8 b 0.006mol/(L��min) 0.3a kJ B
����������1������������ˮ��Ӧ����һ�����������ᣬ����������ԭ��Ӧԭ���ɵ÷�Ӧ����ʽΪ��3NO2+H2O![]() 2HNO3+NO��NO2��NԪ�ػ��ϼ۽��ͣ���+4�۽��͵�0�ۣ���6molNO2�μӷ�Ӧ��ת��24mol���ӣ����Ե�ת��1��2mol����ʱ������NO20��3mol�����Ϊ6��72L����2����֪����2SO2��g��+O2��g��2SO3��g����H=-196��6kJmol-1��2NO��g��+O2��g��2NO2��g����H=-113��0kJmol-1�����ø�˹���ɣ��١�
2HNO3+NO��NO2��NԪ�ػ��ϼ۽��ͣ���+4�۽��͵�0�ۣ���6molNO2�μӷ�Ӧ��ת��24mol���ӣ����Ե�ת��1��2mol����ʱ������NO20��3mol�����Ϊ6��72L����2����֪����2SO2��g��+O2��g��2SO3��g����H=-196��6kJmol-1��2NO��g��+O2��g��2NO2��g����H=-113��0kJmol-1�����ø�˹���ɣ��١� ![]() +����
+����![]() ��NO2��g��+SO2��g��SO3��g��+NO��g����H=
��NO2��g��+SO2��g��SO3��g��+NO��g����H=![]() ����-196��6kJmol-1��-
����-196��6kJmol-1��-![]() ����-113��0kJmol-1��=-41��8kJmol-1��a����Ӧ�ں����ܱվ��������н��У��������Ƿ�ﵽƽ�⣬��ϵѹǿ�����ֲ��䣬���������ж��Ƿ�ﵽƽ��״̬��ѡ��a����b�����������ɫ���ֲ��䣬˵��Ũ�Ȳ��䣬�ﵽƽ��״̬��ѡ��b��ȷ��c��SO3��NO�ļ�����֮��Ϊ1��1�������Ƿ�ﵽƽ�⣬���ߵ�����ȱ��ֲ��䣬�����ж��Ƿ�ﵽƽ��״̬��ѡ��c����d�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ÿ����1mol SO3��ͬʱ����1molNO2�������ж��Ƿ�ﵽƽ��״̬��ѡ��d����ѡb����3����ƽ��ʱCO��С��Ũ��Ϊx����
����-113��0kJmol-1��=-41��8kJmol-1��a����Ӧ�ں����ܱվ��������н��У��������Ƿ�ﵽƽ�⣬��ϵѹǿ�����ֲ��䣬���������ж��Ƿ�ﵽƽ��״̬��ѡ��a����b�����������ɫ���ֲ��䣬˵��Ũ�Ȳ��䣬�ﵽƽ��״̬��ѡ��b��ȷ��c��SO3��NO�ļ�����֮��Ϊ1��1�������Ƿ�ﵽƽ�⣬���ߵ�����ȱ��ֲ��䣬�����ж��Ƿ�ﵽƽ��״̬��ѡ��c����d�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���ÿ����1mol SO3��ͬʱ����1molNO2�������ж��Ƿ�ﵽƽ��״̬��ѡ��d����ѡb����3����ƽ��ʱCO��С��Ũ��Ϊx����
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼʱŨ��mol/L 0.1 0.2 0
�ı��Ũ��mol/L x 2x x
ƽ��ʱŨ��mol/L 0.1-x 0.2-2x x
����5min�ﵽƽ������ʱ������ѹǿΪ��Ӧǰ��0.8����ѹǿ֮�ȵ������ʵ���֮�ȣ����У� ![]() =0.8�����x=0.03mol/L��v����CH3OH��=
=0.8�����x=0.03mol/L��v����CH3OH��=![]() =0.006mol/(L��min)����Ӧ��ת����Ϊ��
=0.006mol/(L��min)����Ӧ��ת����Ϊ�� ![]() ��100%=30%��������Ӧ�ų�������Ϊa kJ��mol-1��30%=0.3a kJ����4����ѧ��Ӧƽ����жϿɴ����¼����濼�ǣ���ϵ�����з�Ӧ������������������Ũ�ȣ����ֲ��䣬����Ӧ���ʵ����淴Ӧ���ʡ�����N2O4(g)
��100%=30%��������Ӧ�ų�������Ϊa kJ��mol-1��30%=0.3a kJ����4����ѧ��Ӧƽ����жϿɴ����¼����濼�ǣ���ϵ�����з�Ӧ������������������Ũ�ȣ����ֲ��䣬����Ӧ���ʵ����淴Ӧ���ʡ�����N2O4(g) ![]() 2NO2(g)����Ӧ��������A���ܶȲ��䣬˵��������䣬ѡ��A��˵���ﵽƽ��״̬��B����H=E��-E������H����ʱ��ı仯���������Ż�ѧ�������ı仯���仯������˵���ﵽƽ��״̬��C��ͼ�б�ʾv(NO2)��= 2v(N2O4)����˵�����淴Ӧ������ȣ���˵���ﵽƽ��״̬��D��N2O4��ת���ʲ��䣬Ҳ˵���˻�ѧ��Ӧ�ﵽƽ��״̬����ѡB��
2NO2(g)����Ӧ��������A���ܶȲ��䣬˵��������䣬ѡ��A��˵���ﵽƽ��״̬��B����H=E��-E������H����ʱ��ı仯���������Ż�ѧ�������ı仯���仯������˵���ﵽƽ��״̬��C��ͼ�б�ʾv(NO2)��= 2v(N2O4)����˵�����淴Ӧ������ȣ���˵���ﵽƽ��״̬��D��N2O4��ת���ʲ��䣬Ҳ˵���˻�ѧ��Ӧ�ﵽƽ��״̬����ѡB��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na��Na2O��Na2O2�Ļ������������ˮ��Ӧ���ڱ�״���µõ�672mL������壬���������ͨ���ǡ����ȫ��Ӧ����Na��Na2O��Na2O2�����ʵ���֮��Ϊ�� ��
A.4��3��2
B.1��2��1
C.2��1��1
D.1��1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ú��Ϊȼ�Ͽ�ͨ����������;����
;���� C(s) + O2(g) �� CO2(g)����H = ��393.15 kJ��mol��1 ��
;���� ���Ƴ�ˮú����
C(s) + H2O(g) �� CO(g) + H2(g)�� ��H2 ��
��ȼ��ˮú����
2CO(g) + O2(g) �� 2CO2(g)�� ��H= ��566kJ��mol��1 ��
2H2(g) + O2(g) �� 2H2O(g)����H= ��484 kJ��mol��1 ��
��ش��������⣺
��1��;����ų�������������_________(����ڡ������ڡ���С�ڡ�);����ų���������
��2����H2��_______________��
��3��úȼ�յ�����(��Ҫ��Ⱦ��SO2��NOx)��O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ
NO(g)��O3(g)==NO2(g)��O2(g) ��H����200.9kJ��mol��1
NO(g)��![]() O2(g)==NO2(g) ��H����58.2kJ��mol��1
O2(g)==NO2(g) ��H����58.2kJ��mol��1
SO2(g)��O3(g)==SO3(g)��O2(g) ��H����241.6kJ��mol��1
��Ӧ3NO(g)��O3(g)==3NO2(g)�Ħ�H��________kJ��mol��1��
��4����֪���и����Ȼ�ѧ����ʽ
�� Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 ��H=��25kJ/mol
�� 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ��H=��47kJ/mol
�� Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ��H=+640kJ/mol
��д��FeO(s)��CO(g)��ԭ��Fe��CO2(g)���Ȼ�ѧ����ʽ______________________________��
��5���ڱ�״���µ�11.2L������ȫȼ������CO2 ��Һ̬ˮ�ų�444.8kJ������298K������ȼ���ȵ��Ȼ�ѧ����ʽ______________________________________________________�� ��֪��������1mol��ѧ����Ҫ���յ������ֱ�Ϊ��C=O:745kJ/mol �� O=O:496kJ/mol �� C-H:414kJ/mol �����1molH-O����Ҫ�ṩ������Ϊ____________________ kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڽ����Ƶ�������������ȷ���ǣ� ��
A. �������õ��и� B. �ڿ�����ȼ�����ɰ�ɫ�Ĺ�������
C. ������ͨ��������ú���� D. �ƾ�������ɫ���������ܶȱ�ˮС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤������������˵������ȷ���ǣ� ��
��ͬ�¡�ͬѹ�£���ͬ����ķ��������������ԭ�������
�ڱ�״���£�11.2L�����������ϵĵ���������������ԭ����ΪNA
���ڱ�״���£�22.4L H2O�����ʵ���Ϊ1mol
��4��ʱ5.4mL��ˮ������ԭ������Ϊ0.9NA
��0.1molOH����0.1NA�����ӣ�
A.�٢ڢ�
B.�ڢ�
C.�٢ۢܢ�
D.�ܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ʽ�����������Ѫ�ǵͶ�ͷ�Σ�Ϊ�˷�ֹ����Σ�գ���Ӧ����������Я����������Ӫ���ص�ʳƷ
A. ���� B. ������ C. ��֬ D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ֧50mL��ʽ�ζ�����ʢ���ᣬҺ��ǡ����a mL�̶ȴ����ѹ���Һ��ȫ���ų���ʢ����Ͳ�ڣ�����Һ�����һ����( )
A.a mLB.(50-a) mLC.����(50-a)mLD.����a mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ��ѡ���Կ�����ҩ����ͨ�����·����ϳɣ����ַ�Ӧ������ȥ):
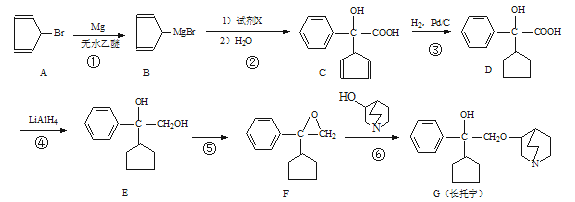
��1���������еĺ���������Ϊ_________��_________�������ƣ���
��2����Ӧ���м����Լ�X�ķ���ʽΪC8H6O3 ��X�Ľṹ��ʽΪ________��
��3����Ӧ�۵ķ�Ӧ����Ϊ_______________��
��4��C��һ��ͬ���칹����������������
I.����FeCl3��Һ������ɫ��Ӧ��
II.�˴Ź���������5�����ҷ�������Ϊ2��4��4��1��1�������к�������������д����ͬ���칹��Ľṹ��ʽ��_________________��
��5����������֪ʶ����������Ϣ��д����![]() ��
��![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�_______________
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�_______________
CH3CH2Br ![]() CH3CH2OH
CH3CH2OH ![]() CH3COOCH2CH3
CH3COOCH2CH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С�齫һ�����ӷ���������õ���Cu��Al��Fe������Au��Pt�Ƚ����Ļ�������������Ʊ�����ͭ�������ˮ�Ȼ����ķ�����

��֪��Cu2++4NH3��H2O=[Cu(NH3)4]2++4H2O
��ش��������⣺
��1�������Cu���ᷴӦ�����ӷ���ʽΪ_________________________��
��2������ڼ�H2O2��������______________������2Ϊ���ѧʽ��__________��
��3������ݲ���ֱ�Ӽ�����ˮ��������________
��4������Һ1��Cu2+��Ũ��Ϊ0.02mol��L-1����������ͭ��ʼ����ʱ��pH=________����֪��Ksp[Cu(OH)2]=2.0x10-20��
��5����֪��2Cu2++4I-=2CuI��+I2 I2+2S2O32-=2I-+S4O62-
ijͬѧΪ�˲ⶨCuSO4��5H2O��Ʒ�����������ɰ����·�����ȡ3.00g��Ʒ����ˮ�ܽ����������KI��Һ����ַ�Ӧ����ˡ�ϴ�ӣ�����Һϡ����250mL��ȡ50mL���������Һ��ָʾ������0.080mol��L-1Na2S2O3����Һ�ζ����ﵽ�ζ��յ��������______________��
�Ĵ�ƽ��ʵ���ȥNa2S2O3����Һ�������£�
ʵ����� | 1 | 2 | 3 | 4 |
����Na2S2O3����Һ��mL�� | 25.00 | 25.02 | 26.20 | 24.98 |
�˲�Ʒ��CuSO4��5H2O����������Ϊ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com