
【题目】把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s) + O2(g) = CO2(g);ΔH = -393.15 kJ·mol-1 ①
途径Ⅱ 先制成水煤气:
C(s) + H2O(g) = CO(g) + H2(g); ΔH2 ②
再燃料水煤气:
2CO(g) + O2(g) = 2CO2(g); ΔH= -566kJ·mol-1 ③
2H2(g) + O2(g) = 2H2O(g);ΔH= -484 kJ·mol-1 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH2=_______________。
(3)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为
NO(g)+O3(g)==NO2(g)+O2(g) ΔH=-200.9kJ·mol-1
NO(g)+![]() O2(g)==NO2(g) ΔH=-58.2kJ·mol-1
O2(g)==NO2(g) ΔH=-58.2kJ·mol-1
SO2(g)+O3(g)==SO3(g)+O2(g) ΔH=-241.6kJ·mol-1
反应3NO(g)+O3(g)==3NO2(g)的ΔH=________kJ·mol-1。
(4)已知下列各组热化学方程式
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H=-25kJ/mol
② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式______________________________。
(5)在标准状况下的11.2L甲烷完全燃烧生成CO2 和液态水放出444.8kJ热量(298K),其燃烧热的热化学方程式______________________________________________________; 已知断裂下列1mol化学键需要吸收的能量分别为:C=O:745kJ/mol , O=O:496kJ/mol , C-H:414kJ/mol 则断裂1molH-O键需要提供的能量为____________________ kJ。
【答案】 等于 +131.85 kJ/mol -317.3 FeO(s)+CO(g)=Fe(s)+CO2(g) △H=-218 kJ/mol CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6 kJ/mol 511.9 kJ
【解析】(1)根据盖斯定律,反应热只与始态与终态有关,与途径无关,途径Ⅰ与途径Ⅱ的始态相同、终态相同反应热相等;(2)已知:①C(s) + O2(g) = CO2(g);ΔH1 = -393.15 kJ·mol-1;③2CO(g) + O2(g) = 2CO2(g); ΔH3= -566kJ·mol-1 ;④2H2(g) + O2(g) = 2H2O(g);ΔH4= -484 kJ·mol-1;根据盖斯定律,由①-![]() ×③-
×③-![]() ×④可得反应②C(s) + H2O(g) = CO(g) + H2(g),则ΔH2=ΔH1-
×④可得反应②C(s) + H2O(g) = CO(g) + H2(g),则ΔH2=ΔH1-![]() ΔH3-
ΔH3-![]() ΔH4=-393.15 kJ·mol-1-
ΔH4=-393.15 kJ·mol-1-![]() ×(-566kJ·mol-1)-
×(-566kJ·mol-1)-![]() ×(-484 kJ·mol-1)=+131.85 kJ/mol;(3)已知:①NO(g)+O3(g)==NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1;②NO(g)+
×(-484 kJ·mol-1)=+131.85 kJ/mol;(3)已知:①NO(g)+O3(g)==NO2(g)+O2(g) ΔH1=-200.9kJ·mol-1;②NO(g)+![]() O2(g)==NO2(g) ΔH2=-58.2kJ·mol-1;③SO2(g)+O3(g)==SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1;根据盖斯定律,由①-2×②可得反应3NO(g)+O3(g)==3NO2(g),则ΔH=ΔH1+2×ΔH2=-200.9kJ·mol-1+2×(-58.2kJ·mol-1)=-317.3 kJ/mol;(4)已知① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H1=-25kJ/mol;② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-47kJ/mol;③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+640kJ/mol;根据盖斯定律,由-
O2(g)==NO2(g) ΔH2=-58.2kJ·mol-1;③SO2(g)+O3(g)==SO3(g)+O2(g) ΔH3=-241.6kJ·mol-1;根据盖斯定律,由①-2×②可得反应3NO(g)+O3(g)==3NO2(g),则ΔH=ΔH1+2×ΔH2=-200.9kJ·mol-1+2×(-58.2kJ·mol-1)=-317.3 kJ/mol;(4)已知① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H1=-25kJ/mol;② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-47kJ/mol;③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+640kJ/mol;根据盖斯定律,由-![]() -
-![]() ×②+
×②+![]() ×①可得反应FeO(s)+CO(g)=Fe(s)+CO2(g) ,则△H=-
×①可得反应FeO(s)+CO(g)=Fe(s)+CO2(g) ,则△H=-![]() ×△H2+
×△H2+![]() ×△H1=-218 kJ/mol;(5)在标准状况下的11.2L甲烷完全燃烧生成CO2 和液态水放出444.8kJ热量(298K,甲烷的物质的量是n(CH4)=
×△H1=-218 kJ/mol;(5)在标准状况下的11.2L甲烷完全燃烧生成CO2 和液态水放出444.8kJ热量(298K,甲烷的物质的量是n(CH4)= ![]() =0.5mol,所以甲烷完全燃烧生成CO2 和液态水的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= —889.6kJ/mol;断裂下列1mol化学键需要吸收的能量分别为:C=O:745kJ/mol, O=O:496kJ/mol ,C-H:414kJ/mol ,反应热是断裂反应物的化学键吸收的热量与产生生成物的化学键所释放的热量的差,则4×414kJ/mol+2mol×496kJ/mol-2mol×745kJ/mol -4×H-O=—889.6kJ。解得H-O的键能是511.9kJ/mol,断裂1molH-O键需要提供的能量为511.9kJ。
=0.5mol,所以甲烷完全燃烧生成CO2 和液态水的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) H= —889.6kJ/mol;断裂下列1mol化学键需要吸收的能量分别为:C=O:745kJ/mol, O=O:496kJ/mol ,C-H:414kJ/mol ,反应热是断裂反应物的化学键吸收的热量与产生生成物的化学键所释放的热量的差,则4×414kJ/mol+2mol×496kJ/mol-2mol×745kJ/mol -4×H-O=—889.6kJ。解得H-O的键能是511.9kJ/mol,断裂1molH-O键需要提供的能量为511.9kJ。


科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关,下列说法错误的是
A. 做油条用的膨松剂不应含明矾
B. 享有“镇国之宝”称谓的“后母戊鼎”属于青铜制品
C. 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D. “煤改气”可以减少SO2等有害物质的排放量,有利于“雾霾”天气的治理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界氮的循环过程如图.回答下列问题。
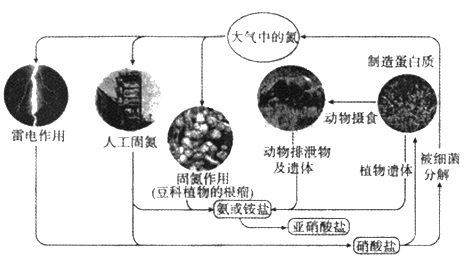
(1)上图中包含了_____种氮的固定方式,写出属于雷电作用固氮的化学方程式________。
(2)合成氮反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是______。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
(3)氮的循环中,亚硝酸盐是重要的一环,利用化合价可推知亚硝酸盐具有_____性和_____性,亚硝酸盐和酸性高锰酸钾反应的离子方程式为__________________。
(4)某同学加热Fe(NO3)2时,发现得到了红色固体和红色气体,且所得气体被水充分吸收后体积少于原体积的l/3,Fe(NO3)2热分解的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中所描述的物质一定是金属元素的是( )
A. 易失去电子的物质
B. 原子最外电子层只有一个电子的元素
C. 单质具有金属光泽的元素
D. 原子的最外电子层只有2个电子且核外电子总数大于3的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B. 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C. 两原子的核外电子排布相同,则一定属于同种元素
D. 一种阳离子和一种阴离子的质子数和电子数可能同时相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于维生素的叙述中,不正确的是
A. 维生素是参与生物发育和新陈代谢所必需的一类小分子
B. 人体对维生素的需要量极小,但对人体的生长和健康至关重要
C. 为保证青少年的健康成长,应大量补充维生素
D. 习惯上把维生素分为脂溶性维生素和水溶性维生素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D四块金属片,进行如下实验: ①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极; ②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D; ③A、C相连后,同时浸入CuSO4溶液中,C极质量增加; ④B、D相连后,同时浸入CuSO4溶液中,Cu2+移向D极被还原。据此,判断四种金属的活动性顺序是( )
A.A>B>D>CB.A>C>D>BC.C>A>B>DD.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为__________________。
利用反应6NO2+8NH3 ![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________ L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_________ L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=﹣196.6 kJ·mol-1
2SO3(g) ΔH=﹣196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=﹣113.0 kJ·mol-1
2NO2(g) ΔH=﹣113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) 的ΔH=__________kJ·mol-1。
SO3(g)+NO(g) 的ΔH=__________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于一恒容密闭绝热容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣a kJ·mol-1。
CH3OH(g) ΔH=﹣a kJ·mol-1。
在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为_____,正反应放出的热量为__________________。
(4)已知N2O4(g) ![]() 2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是________。
2NO2(g) ΔH>0,现将1molN2O4充入一恒压密闭容器中,下列示意图不能说明反应达到平衡状态的是________。



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com