
分析 实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,结合滴定操作的注意事项进行解答:
(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)指示剂为甲基橙,变色范围为3.1-4.4;指示剂为甲基橙,在碱性溶液中为黄色,滴定终点变橙色;
(3)因标准液浓度变小,用量变大;
(4)根据反应消耗的硫酸,求出氢氧化钠,进一步求出样品的纯度.
解答 解:(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,
故答案为:C;A;B;D;E;
(2)指示剂为甲基橙,变色范围为3.1-4.4,终点时pH约为4,溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色,
故答案为:4;溶液由黄色变为橙色,且半分钟内不恢复为原来的颜色;
(3)若酸式滴定管没有用标准H2SO4溶液润洗,相当于标准液被稀释,导致标准液浓度变小,用量变大,使测定结果偏高,
故答案为:偏高;
(4)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×M mol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2M(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:2M(V2-V1)×10-3mol×$\frac{250}{25}$=2M(V2-V1)×10-2mol,
则样品中氢氧化钠的质量为m(NaOH)=n(NaOH)×M(NaOH)=2M(V2-V1)×10-2 mol×40 g/mol=80M(V2-V1)×10-2 g,则该烧碱样品的纯度为:$\frac{80M({V}_{2}-{V}_{1})×1{0}^{-2}g}{Wg}$×100%=$\frac{80M({V}_{1}-{V}_{2})}{W}$%,故答案为:$\frac{80M({V}_{1}-{V}_{2})}{W}$%.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度中等,建议在学习中把握相关基本实验方法,学习中注意积累.


科目:高中化学 来源: 题型:解答题
 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | cB=$\frac{ν_B}{ν_A}$•$\frac{{{c_A}{V_A}}}{V_B}$ | B. | cB=$\frac{ν_B}{ν_A}$•$\frac{{{c_A}{V_B}}}{V_A}$ | ||
| C. | cB=$\frac{{{c_A}{V_A}}}{V_B}$ | D. | cB=$\frac{ν_A}{ν_B}$•$\frac{{{c_A}{V_A}}}{V_B}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

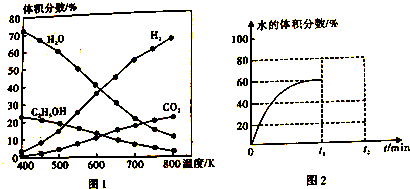
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
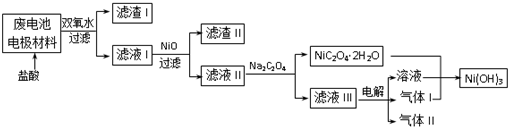
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
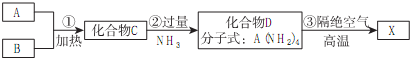

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol Cl2与过量的镁反应,转移 2NA个电子 | |
| B. | 常温常压下,16 g CH4含有 10NA个电子 | |
| C. | 1 mol•L -1 Na2SO4溶液中含有 NA个SO42- | |
| D. | 常温常压下,22.4 L CO2含有N A个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
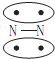 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示π键,下列说法中不正确的是 ( )
,其中椭圆框表示π键,下列说法中不正确的是 ( )| A. | N2分子与CO分子中都含有叁键 | |
| B. | CO分子中有一个π键是配位键 | |
| C. | N2、CO分别由非极性键和极性键结合,因此二者不是等电子体 | |
| D. | N2与CO的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2═Fe3++2H2O | |
| B. | 已知同温度下的溶解度:Zn(OH)2>ZnS,Na2S溶液与ZnCl2溶液混合:Zn2++S2-+2H2O═Zn(OH)2↓+H2S↑ | |
| C. | 0.01 mol•L-1NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 向KI-淀粉溶液中加入稀硫酸,在空气中放置一段时间后,溶液呈蓝色:4H++4I-+O2═2I2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com