
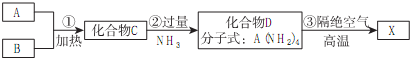

分析 (1)I可做光导纤维,所以I是二氧化硅,则F是硅酸,H是硅酸钠.又因为F、G都是难溶于水和稀硝酸的白色沉淀,所以G是氯化银,因此C是SiCl4,则A是硅,B是氯气.根据X的性质可知,X是原子晶体,所以X是Si3N4.
(2)由转化关系可知,SiCl4与NH3反应生成Si(NH2)4,根据原子守恒可知还生成HCl,由于氨气过量,故应生成NH4Cl;
(3)CO2是过量的,因此生成物是碳酸氢钠与硅酸.
解答 解:(1)I可做光导纤维,所以I是二氧化硅,则F是硅酸,H是硅酸钠,又因为F、G都是难溶于水和稀硝酸的白色沉淀,所以G是氯化银,因此C是SiCl4,其空间构型为正四面体,则A是硅,B是氯气.根据X的性质可知,X是原子晶体,所以X是Si3N4,
故答案为:正四面体;Si3N4;
(2)由转化关系可知,SiCl4与NH3反应生成Si(NH2)4,根据原子守恒可知还生成HCl,由于氨气过量,故应生成NH4Cl,故反应②的反应方程式为:SiCl4+8NH3═Si(NH2)4+4NH4Cl,
故答案为:SiCl4+8NH3═Si(NH2)4+4NH4Cl;
(3)CO2是过量的,因此生成物是碳酸氢钠与硅酸,反应⑦的离子方程式为:SiO32-+2H2O+2CO2═H2SiO3↓+2HCO3-,
故答案为:SiO32-+2H2O+2CO2═H2SiO3↓+2HCO3-.
点评 本题考查无机物的推断,“I可做光导纤维”是突破口,据此结合转化关系利用逆推法推断,(2)中方程式书写为易错点,学生容易忽略氨气过量而认为生成HCl.


科目:高中化学 来源: 题型:选择题

| A. | 离子半径:W3+>Z+>Y2- | |
| B. | X、Y都存在同素异形现象 | |
| C. | Z和Y形成的化合物中只存在离子键 | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知浓度的盐酸溶液时,锥形瓶使用前中含有少量水 | |
| D. | 用标准盐酸测定未知浓度NaOH溶液,结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应 2H2O+O2+4e-═4OH- | |
| B. | 表示H2燃烧热的热化学方程式 2H2(g)+O2 (g)═2H2O(g);△H=-483.6kJ/mol | |
| C. | 纯碱水解的离子方程式 CO32-+H2O?HCO3-+OH- | |
| D. | Ca(HCO3)2溶液中加入过量澄清石灰水 Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H2、HClO、C2H6 | B. | CO2、N2O、HC≡CH | ||
| C. | C6H5CH3、C3H4、CH4 | D. | C6H6、C2H4、HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 3D打印技术采用钛合金粉末为原料制造飞机钛合金结构件,高温时可用金属钠还原钛的氯化物制取金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在羽毛球、网球等体育项目中做球拍的碳纤维材料是一种新型无机非金属材料 | |
| B. | 从海水中提取溴和镁都必须通过化学反应才能实现 | |
| C. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| D. | 用饱和NH4Cl溶液可除去铁表面的锈斑 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com