
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700 g样品,配制成100.00 mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00  mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:
mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:
2MnO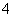 +5H2O2+6H+===2Mn2++8H2O+5O2↑
+5H2O2+6H+===2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO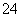 )≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥_______mol·L-1。
)≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥_______mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO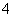 被还原为MnO2,其离子方程式为__________________。
被还原为MnO2,其离子方程式为__________________。
答案:(1)1.1×10-4
(2)2MnO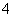 +3H2O===2MnO2↓+3O2↑+2OH-+2H2O
+3H2O===2MnO2↓+3O2↑+2OH-+2H2O
(3)n(Na2SO4)=n(BaSO4)=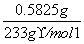 =2.50×10-3 mol
=2.50×10-3 mol
2MnO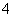 +5H2O2+6H+===2Mn2++8H2O+5O2↑
+5H2O2+6H+===2Mn2++8H2O+5O2↑
n(H2O2)=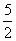 ×
×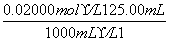 =1.25×10-3 mol
=1.25×10-3 mol
m(Na2SO4)=142 g·mol-1×2.50×10-3 mol=0.355 g
m(H2O2)=34 g·mol-1×1.25×10-3 mol=0.0425 g
n(H2O)=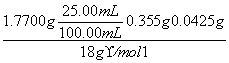 =2.50×10-3 mol
=2.50×10-3 mol
x∶y∶z=n(Na2SO4 )∶n(H2O2)∶n(H2O)=2∶1∶2
)∶n(H2O2)∶n(H2O)=2∶1∶2
硫酸钠-过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O
解析:(1)依据Ksp=c(Ba2+)·c(SO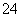 )可知c(Ba2+)=
)可知c(Ba2+)=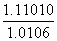 =1.1×10-4(mol·L-1)。
=1.1×10-4(mol·L-1)。
(2)MnO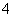 被还原为Mn
被还原为Mn O2,所以H2O2被氧化生成O2,可得MnO
O2,所以H2O2被氧化生成O2,可得MnO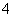 +H2O2―→MnO2+O2+H2O,依据化合价守恒可知2MnO
+H2O2―→MnO2+O2+H2O,依据化合价守恒可知2MnO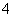 +3H2O2―→2MnO2+3O2+H2O,依据电荷守恒可知还生成2个OH-,依据H原子守恒可知生成2个H2O,即2MnO
+3H2O2―→2MnO2+3O2+H2O,依据电荷守恒可知还生成2个OH-,依据H原子守恒可知生成2个H2O,即2MnO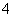 +3H2O2===2MnO2↓+3O2↑+2OH-+2H2O,最后用氧检查是否正确。
+3H2O2===2MnO2↓+3O2↑+2OH-+2H2O,最后用氧检查是否正确。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B. 对于反应2H2O2 =2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
C. 将铜片放入稀硫酸中,无现象。若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生
D. 100mL 2mol/L的盐酸跟锌片反 应,加入适量的氯化钠溶液,反应速度不变
应,加入适量的氯化钠溶液,反应速度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一种中强酸,写出其电离方程式:_____________________________
________________________________________________________________________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为________。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。
③NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________________________________________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
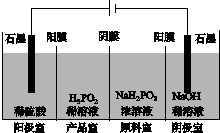
①写出阳极的电极反应式:_________________________________________。
②分析产品室可得到H3PO2的原因:_____________________________________
________________________________________________________________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O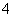 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能源是一种重要的清洁能源。现 有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时
有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时 还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回
还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回 答下列问题:
答下列问题:
(1)甲的化学式是 ;乙的电子式是 。
(2)甲与水反应的化学方程式是 。
(3)气体丙与金属镁反应的产物是 (用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式  。有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之
。有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之
。
(已知:Cu2O+2H+ Cu+Cu2++H
Cu+Cu2++H 2O)
2O)
(5)甲与乙之间 (填“可能”或“不可能”)发 生反应产生H2,判断理由
生反应产生H2,判断理由 是
是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO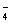 + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
洗车安全气囊是德国安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A. KCl B. KNO3 C. Na2S D. CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)配平氧化还原反应方程式:

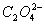 +
+
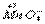 +
+ H+
H+ CO2↑+
CO2↑+ Mn2++
Mn2++ H2O
H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___________________mol。
②第二份溶液中滴加0.10 mol·L-1酸性KMnO4溶液至16 mL时反应完全,此时溶液颜色由_____________变为___________。该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的质量分数为__________,KHC2O4的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。
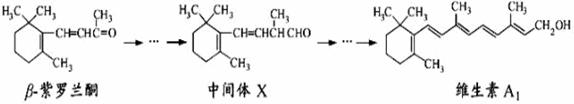
下列说法正确的是
A.β—紫罗兰酮可使酸性KMnO4溶液褪色
B.1mol中间体X最多能与2molH2发生加成反应
C.维生素A1易溶于NaOH溶液
D.β—紫罗兰酮与中间体X互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com