
(1)配平氧化还原反应方程式:

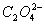 +
+
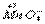 +
+ H+
H+ CO2↑+
CO2↑+ Mn2++
Mn2++ H2O
H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___________________mol。
②第二份溶液中滴加0.10 mol·L-1酸性KMnO4溶液至16 mL时反应完全,此时溶液颜色由_____________变为___________。该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的质量分数为__________,KHC2O4的质量分数为_________。
【答案】
(1)5 2 16 10 2 8
(2)①0.005
②无色 紫红色 0.004
③21% 64%
【解析】(1)根据化合价升降法配平方程式:
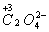

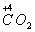 (1×2)×5
(1×2)×5
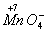

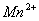 5×2
5×2
配平后化学计量数为:5、2、16、10、2、8。
(2)①当溶液由无色变为浅红色时,达到滴定终点,此时溶液被中和的H+物质的量即为消耗的OH-物质的量或NaOH的物质的量,故为:0.25 mol·L-1×0.02 L=0.005 mol。
②滴加酸性KMnO4溶液16 m L至完全反应时,溶液颜色由无色变为紫红色。根据上述反应关系:
L至完全反应时,溶液颜色由无色变为紫红色。根据上述反应关系:
2KMnO4 — 5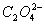
0.1 mol·L-1×0.016 L 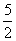 ×0.1×0.016 mol
×0.1×0.016 mol
即还原剂的物质的量为0.004 mol。
③设原试样中H2C2O4·2H2O、KHC2O4物质的量分别为x、y,则:
由①知2x+y=0.005 mol,由②知x+y=0.004 mol
解方程组得x=0.001 mol,y=0.003 mol
故H2C2O4·2H2O质量分数为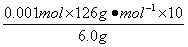 ×100%=21%,
×100%=21%,
KHC2O4质量分数为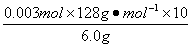 ×100%=64%。
×100%=64%。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O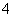 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.7700 g样品,配制成100.00 mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00  mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:
mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:
2MnO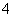 +5H2O2+6H+===2Mn2++8H2O+5O2↑
+5H2O2+6H+===2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO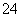 )≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥_______mol·L-1。
)≤1.0×10-6mol·L-1,应保持溶液中c(Ba2+)≥_______mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO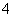 被还原为MnO2,其离子方程式为__________________。
被还原为MnO2,其离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某厂废水中含5.00×10-3 mol·L-1的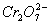 ,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁
,其毒性较大。某研究性学习小组为了变废为宝,将废水处理得到磁 性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程:
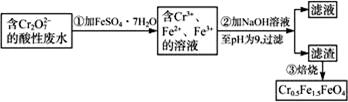
(1)第①步反应的离子方程式是____________________________________。
(2)第②步中用pH试纸测定溶液pH的操作是:__________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有__________________。
(4)欲使1 L该废水中的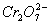 完全转化为Cr0.5Fe1.5FeO4,理论上需要加入_________g FeSO4·7H2O。
完全转化为Cr0.5Fe1.5FeO4,理论上需要加入_________g FeSO4·7H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+====2Fe3++2H2O
2Fe3++H2O2====2Fe2++O2↑+2H+
下列说法正确的是( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
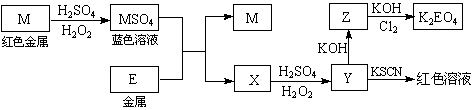
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
⑷由E制备的E(C2H5)2的结构如下图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: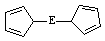 。核磁
。核磁 共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧气还原反应:
2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O
其中1mol氧化剂在反应中得到的电子为
A.10 mol B.11 mol
C.12 mol D.13 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式________。
(2) PX可发生的反应有________、________(填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A是PX的一种同分异构体。
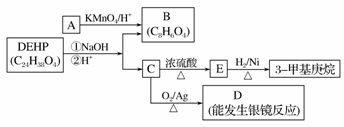
①B的苯环上存在2种不同化学环境的氢原子,则B的结构简式是________。
②D分子所含官能团是________(填名称)。
③C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是________。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
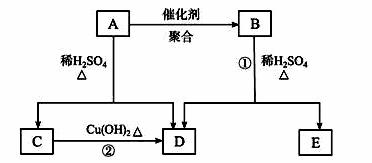
已知R—CH==CHOH(烯醇)不稳定,很快转化为R—CH2CHO。
根据以上信息回答下列问题:
(1)A的分子式为_______________________;
(2)反应②的化学方程式是_______________________;
(3)A的结构简式是_______________________;
(4)反应①的化学方程式是_______________________;
(5)A有多种同分异构体,写出四个同时满足(i)能发生水解反应、(ii)能使溴的四氯化碳溶液褪色两个条件的同分异构体的结构简式:___________、____________、____________、____________;
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com