
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+====2Fe3++2H2O
2Fe3++H2O2====2Fe2++O2↑+2H+
下列说法正确的是( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
下列解释事实的方程式不正确的是( )
A.测0.1 mol/L氨水的pH为11:
NH3·H2O NH
NH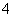 +OH-
+OH-
B.将Na块放入水中,产生气体:
2Na+2H2O===2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:
CuCl2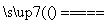 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O===2AlO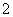 +3H2↑
+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能源是一种重要的清洁能源。现 有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时
有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时 还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回
还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回 答下列问题:
答下列问题:
(1)甲的化学式是 ;乙的电子式是 。
(2)甲与水反应的化学方程式是 。
(3)气体丙与金属镁反应的产物是 (用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式  。有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之
。有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之
。
(已知:Cu2O+2H+ Cu+Cu2++H
Cu+Cu2++H 2O)
2O)
(5)甲与乙之间 (填“可能”或“不可能”)发 生反应产生H2,判断理由
生反应产生H2,判断理由 是
是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
洗车安全气囊是德国安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A. KCl B. KNO3 C. Na2S D. CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为__________________。
(3)根据上述反应可推知__________________。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:

查看答案和解析>>
科目:高中化学 来源: 题型:
(1)配平氧化还原反应方程式:

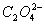 +
+
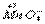 +
+ H+
H+ CO2↑+
CO2↑+ Mn2++
Mn2++ H2O
H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入2滴酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___________________mol。
②第二份溶液中滴加0.10 mol·L-1酸性KMnO4溶液至16 mL时反应完全,此时溶液颜色由_____________变为___________。该溶液中还原剂的物质的量为________mol。
③原试样中H2C2O4·2H2O的质量分数为__________,KHC2O4的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下 列有关化学基本概念的依据正确的是
列有关化学基本概念的依据正确的是
A 氧化还原反应:元素化合价是否变化
B 共价化合物:是否含有共价键
C 强弱电解质:溶液的导电能力大小
D 金属晶体:晶体是否能够导电
查看答案和解析>>
科目:高中化学 来源: 题型:
“化学与技术”模块请在标有序号的空白处填空,并将序号及相应答案写在答题纸上:
以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答有关问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是(可多选)____________。
A.CH2====CH2+HCl CH3CH2Cl
CH3CH2Cl
B.CH3CH2OH+HCl CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2 CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2CHCl+H2 CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性高的是___________反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、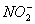 和CN-等有毒有害的还原性酸根离子氧化去除。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________,并说明该方法的优点________。
和CN-等有毒有害的还原性酸根离子氧化去除。请写出用ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________,并说明该方法的优点________。
(3)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
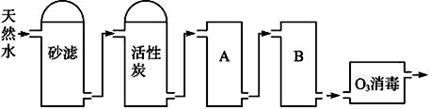
活性炭的作用是__________________;O3消毒的优点是__________________。
A、B中放置的物质名称分别是:A__________________;B__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com