
【题目】下列分子中所有原子都满足最外层为8电子结构的是
A. BF3B. H2OC. CO2D. NO2
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
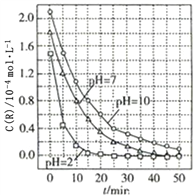
A. 在20~25min之间,pH=10时R的平均降解速率为0.04molL-1min-1
B. 溶液酸性越强,R的降解速率越小
C. R的起始浓度越小,降解速率越大
D. 50min时,pH=2和pH=7时R的降解百分率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:

资料a: Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH见下表(金属离子的起始浓度为0.1 mol·L-1)
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程I的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是__________________________________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:取少量滤液1于试管中,滴入黄色K3[Fe(CN)6](铁氰化钾)溶液,无明显变化:另取少量滤液1于试管中,___________________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:i.2Fe2++Cl2=2Fe3++2Cl-
ii.4Fe2++O2+4H+=4Fe3++2H2O iii.……
写出iii的离子方程式:___________________________。
(2)过程II的目的是除铁,有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ii.焙烧法:将滤液1浓缩得到的固体于290°C焙烧,冷却,取焙烧物……
己知:焙烧中发生的主要反应2FeCl3+3O2=2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在 _______________之间。
②补全ii中的操作:____________________。
③两种方法比较,氨水法除铁的缺点是_________________________________________。
(3)过程III的目的是除铅。加入的试剂是______________________。
(4)过程IV所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,质量变为m2g。则x=________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。
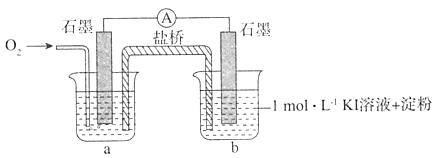
i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是 ( )
A. 蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发。
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VL硫酸钠中含Na+质量为m g,则
A. m/23V mol/L B.23/mV mol/L C.2m/23 V mol/L D. m/46Vmol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组物质中,属于同系物的是( )
A. 甲烷和2,2-二甲基丁烷B. 1,1-二氯乙烷和l,2-二氯乙烷
C. 乙二醇和丙三醇D. 苯酚和苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质谱测出,某烃A的相对分子质量为70,回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等的是(填序号)_______。
a.C2H4b.C3H8c.C6H6d.C4H6O
(2)若烃A为链烃,联合红外光谱及其它分析手段,显示该分子含有3个-CH3。
①A的结构简式为__________;
②链烃A与Br2的CCl4溶液反应生成B;B与NaOH的醇溶液共热可得到D,D分子中无溴原子。(提示:碳原子连接两个碳碳双键的结构不稳定)。请写出D的结构简式______;D能发生聚合反应,且聚合产物主链含有碳碳双键,写出D生成E的反应方程式______________。
③B与足量NaOH水溶液完全反应,生成有机物F,该反应的化学方程式为______。
(3)若核磁共振氢谱显示链烃A有四组不同的峰,峰面积比为6::2:1:1,则A的名称为____。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com