
����Ŀ�����ײ����ij��A����Է�������Ϊ70���ش��������⣺
��1������������A�����������ϣ��������ʵ���һ�������ȼ����������������ȵ���(�����)_______��
a��C2H4b��C3H8c��C6H6d��C4H6O
��2������AΪ���������Ϻ���������������ֶΣ���ʾ�÷��Ӻ���3��-CH3��
��A�Ľṹ��ʽΪ__________��
������A��Br2��CCl4��Һ��Ӧ����B��B��NaOH�Ĵ���Һ���ȿɵõ�D��D����������ԭ�ӡ�����ʾ��̼ԭ����������̼̼˫���Ľṹ���ȶ�������д��D�Ľṹ��ʽ______��D�ܷ����ۺϷ�Ӧ���Ҿۺϲ�����������̼̼˫����д��D����E�ķ�Ӧ����ʽ______________��
��B������NaOHˮ��Һ��ȫ��Ӧ�������л���F���÷�Ӧ�Ļ�ѧ����ʽΪ______��
��3�����˴Ź���������ʾ����A�����鲻ͬ�ķ壬�������Ϊ6��:2��1��1����A������Ϊ____��
��4����A����ʹ��ˮ��ɫ������һ�ȴ���ֻ��һ�֣���A�Ľṹ��ʽΪ_________��
���𰸡� c (CH3)2C=CHCH3 CH2=CCH3CH=CH2 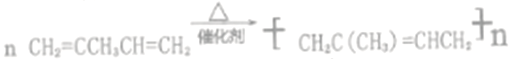 (CH3)2CBrCHBrCH3+2NaOH
(CH3)2CBrCHBrCH3+2NaOH![]() (CH3)2C(OH)CH(OH)CH3+2NaBr 3-��-1-��ϩ
(CH3)2C(OH)CH(OH)CH3+2NaBr 3-��-1-��ϩ ![]()
�����������ײ����ij��A����Է�������Ϊ70������70/14=5����A�ķ���ʽΪC5H10��
��1�������л���ȼ��ͨʽCxHyOz��(x+![]() ��
��![]() )O2
)O2![]() xCO2��
xCO2��![]() H2O��֪�����ʵ���һ�������ȼ����������������ȣ���һ������(x+
H2O��֪�����ʵ���һ�������ȼ����������������ȣ���һ������(x+![]() ��
��![]() )�Ƕ�ֵ��A��D��(x+
)�Ƕ�ֵ��A��D��(x+![]() ��
��![]() )�ֱ���3��5��7.5��5������A��(x+
)�ֱ���3��5��7.5��5������A��(x+![]() ��
��![]() )��7.5����ѡc����2��������AΪ���������A��ϩ�������Ϻ���������������ֶΣ���ʾ�÷��Ӻ���3��-CH3����A�Ľṹ��ʽΪ(CH3)2C=CHCH3��������A��Br2��CCl4��Һ��Ӧ����B��B���ṹʽΪ(CH3)2CBrCHBrCH3��B��NaOH�Ĵ���Һ���ȿɵõ�D���÷�Ӧ��±��������ȥ��Ӧ��D����������ԭ�����D�Ľṹ��ʽWΪCH2=C(CH3)CH=CH2��D�ܷ����ۺϷ�Ӧ���Ҿۺϲ�����������̼̼˫������D����E�ķ�Ӧ����ʽΪ
)��7.5����ѡc����2��������AΪ���������A��ϩ�������Ϻ���������������ֶΣ���ʾ�÷��Ӻ���3��-CH3����A�Ľṹ��ʽΪ(CH3)2C=CHCH3��������A��Br2��CCl4��Һ��Ӧ����B��B���ṹʽΪ(CH3)2CBrCHBrCH3��B��NaOH�Ĵ���Һ���ȿɵõ�D���÷�Ӧ��±��������ȥ��Ӧ��D����������ԭ�����D�Ľṹ��ʽWΪCH2=C(CH3)CH=CH2��D�ܷ����ۺϷ�Ӧ���Ҿۺϲ�����������̼̼˫������D����E�ķ�Ӧ����ʽΪ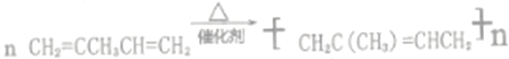 ����B������NaOHˮ��Һ��ȫ��Ӧ�������л���F��F�Ƕ�Ԫ�����÷�Ӧ�Ļ�ѧ����ʽΪ(CH3)2CBrCHBrCH3+2NaOH
����B������NaOHˮ��Һ��ȫ��Ӧ�������л���F��F�Ƕ�Ԫ�����÷�Ӧ�Ļ�ѧ����ʽΪ(CH3)2CBrCHBrCH3+2NaOH![]() (CH3)2C(OH)CH(OH)CH3+2NaBr����3�����˴Ź���������ʾ����A�����鲻ͬ�ķ壬�������Ϊ6��2��1��1����A�Ľṹ��ʽΪCH2��CHCH(CH3)2��������Ϊ3-��-1-��ϩ����4����A����ʹ��ˮ��ɫ�����A�ǻ�����������һ�ȴ���ֻ��һ�֣�����������ԭ����ȫ��ͬ����A�Ľṹ��ʽΪ
(CH3)2C(OH)CH(OH)CH3+2NaBr����3�����˴Ź���������ʾ����A�����鲻ͬ�ķ壬�������Ϊ6��2��1��1����A�Ľṹ��ʽΪCH2��CHCH(CH3)2��������Ϊ3-��-1-��ϩ����4����A����ʹ��ˮ��ɫ�����A�ǻ�����������һ�ȴ���ֻ��һ�֣�����������ԭ����ȫ��ͬ����A�Ľṹ��ʽΪ![]() ��
��


 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���������ԭ�Ӷ����������Ϊ8���ӽṹ����
A. BF3B. H2OC. CO2D. NO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����������Һ��˵����ȷ����
A. �����¶����䣬��ˮ�м�������CH3COONa��ˮ�������c(H+)��c(OH-)�˻�����
B. 25����ij��ˮ�м�������ʹ��Һ��c(NH4+)=c(Cl-)����ʱ��ҺpH=7
C. ��0.1mol/LCH3COOH��Һ��20��������30�棬��Һ�� ��С
��С
D. �����¶Ȳ��䣬��CH3COONa��Һ�м�������NaOH����Һ�� ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�л���F�Ǻϳ�һ�����ͽ�ѹ����ɳ̹���м��壬������ͼ��ʾ��·�ߺϳɣ�

��֪��![]()
��ش��������⣺
(1)A��������Ϊ________________��
(2)������D�����������ŵ�����Ϊ_________________��
(3)��Ӧ��������Լ�Ϊ_____________��
(4)��ɢݢ�Ӧ�ķ���ʽ��ע����Ӧ����
��_______________________����Ӧ����________________��
��_______________________����Ӧ����_________________��
(5)��������������C��ͬ���칹����____�֣����к˴Ź���������ʾ4�����������Ϊ3��2��2��1����_______�֡�
��.������ ��.��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�1�dz����¼�������ĵ���ƽ��������Ka��������ĵ���ƽ�ⳣ����Kb������2ʱ�����¼����ѣ���������ܶȻ�������Kap��
��1 | |
���� | ���볣����Ka��Kb�� |
CH3COOH | 1.8��10-5 |
HIO3 | 1.7��10-1 |
HCN | 5��10-10 |
HClO | 3��10-8 |
NH3H2O | 1.8��10-5 |
��2 | |
�ѣ������� | �ܶȻ�������Ksp�� |
BaSO4 | 1��10-10 |
BaCO3 | 2.6��10-9 |
��ش���������:
(1)�����������У�������ǿ����______________(�û�ѧʽ��ʾ)��������ʹ������Һ��CH3COOH�ĵ�����������볣������IJ�����______(�����)��
A.�����¶� B.��ˮϡ�� C.��������CH3COONa���� D.������������
(2)HCOONH4��ˮ��Һ��_______(ѡ����ԡ��������ԡ��������ԡ�)��д��HCOONH4ˮ������ӷ�Ӧ����ʽ____________��
(3)���ʵ���1��1��NaCN��HCN�Ļ����Һ����pH>7������Һ�����ӵ�Ũ�ȴӴ�С����Ϊ___��
(4)��ҵ�г���BaSO4ת��ΪBaCO3���ٽ����Ƴɸ��ֿ����Եı���(��:BaCl2)�������������ñ��͵Ĵ�����Һ����BaSO4��ĩ�������ϲ��䴿����BaSO4ת��ΪBaCO3������������BaSO4����Һ���ڸ�����Һ�мӴ����ĩ�����Ͻ��裬���� SO42-���ʵ���Ũ�ȴﵽ0.05mol��L-1�����ʱ��Һ��CO32-���ʵ���Ũ��Ӧ_____________mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��뷽������������( )
A. ��ʯ���еõ����ͣ���������ķ���
B. ��ȡ��ˮ�е��壬���ü����Ҵ���ȡ�ķ���
C. ֻ������ɳ�Ĵ��Σ���ͨ���ܽ⡢���ˡ��ᾧ�ķ����ᴿ
D. ��FeCl2��Һ�е�����FeCl3�����ü���������м���˵ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±�����Ҫ�ɷ���MgCl2���������Fe3+��Fe2+��Mn2+�����ӡ�������Ϊԭ�ϰ���ͼ��ʾ�������̽������������Ƶ���������þ��
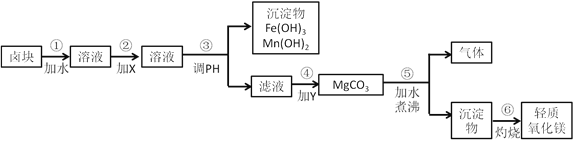
Ҫ���Ʒ�����������ʣ����������ɱ��ϵͣ�����ݱ����ṩ�����ϣ��ش��������⡣

��1���ڲ�����м�����Լ�X����ѵ�ѡ����______����������__________��
��2���ڲ�����м�����Լ�Y��_______________________��
��3���ڲ�����з�����Ӧ�Ļ�ѧ����ʽ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaNO2������ʳƷ���Ӽ���NaNO2�ܷ������·�Ӧ��
3NO2-��2H+=NO3-��2NO����H2O NO2-+Ag+=AgNO2��������ɫ��
ij��ѧ��ȤС���������̽�����ش��й����⣺
��l����ȡNaNO2
��Ӧԭ����Na2CO3+2NO2=NaNO2+NaNO3+CO2
Na2CO3��NO+ NO2=2NaNO2+CO2
����ͼ��ʾװ�ý���ʵ�顣

�� ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ___________��
�� ʵ������У������B����Һ��pH>7��������ʻ��½���������________��
�� ��C��ͨ�������Ŀ����_______________���û�ѧ����ʽ��ʾ����
�� ��Ӧ������B����Һ������Ũ������ȴ��Ʒ��______�Ȳ������ɵõ��ֲ�Ʒ�����ĸҺ��
��2���ⶨ�ֲ�Ʒ��NaNO2�ĺ���
��ȡmg�ֲ�Ʒ���ܽ��ϡ����250mL��ȡ��25.00 mL��Һ����cmol/LKMNO4������Һƽ�еζ����Σ�ƽ�����ĵ����ΪVmL��
��֪��2MnO4-+6H++5NO2-��5NO3-��2Mn2++3H2O
�� ϡ����Һʱ����ʹ�õIJ����������ձ����������⣬����______ �����ţ���
A������ƿ B.��Ͳ C����ͷ�ι� D����ƿ
�� ���۲쵽_______ʱ���ζ��ﵽ�յ㡣
�� �ֲ�Ʒ��NaNO2����������Ϊ________���ô���ʽ��ʾ����
��3�����ʵ�鷽��֤��ĸҺ�к���NO2-_____________����ѡ�õ��Լ������ᡢ��������Һ�����ᱵ��Һ���Ȼ�����Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ѡ����ʵ�ͼ������ĸ��գ�

��1����������������п��a��b�ֱ���������ϡ�����У�ͬʱ��a�м���������CuSO4��Һ������H2�����V(L)��ʱ��t(min)�Ĺ�ϵ��ͼ����_______��
��2������1���е�CuSO4��Һ�ij�CH3COONa��Һ�������������䣬��ͼ����_______��
��.Na2FeO4��һ�ּ���ɱ��������������������ˮ�ĸ�Чˮ�������������Ʒ�����ͼ��ʾ���������У������������������Y��������Һ����Ϻ�ɫ��ֹͣʵ�飬���缫���Ա�ϸ�����Һ�Գ��塣�������ϵ�֪�������������(FeO42-)����Һ�г��Ϻ�ɫ��

��3���������У�X������Һ��pH______(�������С�����䡱)��
��4���������У�Y�������ĵ缫��ӦΪ___________��_____________��
��5������X���ռ���672 mL���壬��Y���ռ���168 mL����(��������Ϊ��״��ʱ�������)����Y�缫(���缫)��������__________g��
��6���ڼ���п����У��ø��������Ϊ�������ϣ���ط�ӦΪ2K2FeO4��3Zn===Fe2O3��ZnO��2K2ZnO2���õ�������ĵ缫��ӦʽΪ______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com