
【题目】下表1是常温下几种弱酸的电离平衡上述(Ka)和弱碱的电离平衡常数(Kb),表2时常温下几种难(微)溶物的溶度积常数(Kap)
表1 | |
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HIO3 | 1.7×10-1 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3H2O | 1.8×10-5 |
表2 | |
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
请回答下面问题:
(1)上述四种酸中,酸性最强的是______________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)HCOONH4的水溶液呈_______(选填“酸性”、“中性”、“碱性”),写出HCOONH4水解的离子反应方程式____________。
(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为___。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,最终 SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中CO32-物质的量浓度应_____________mol·L-1。
【答案】 HIO3 B 酸性 HCOO-+NH4++H2O=HCOOH+NH3·H2O c(Na+)>c(CN-)>c(OH-)>c(H+) 1.3
【解析】(1)电离平衡常数越大,酸性越强,则上述四种酸中,酸性最强的是HIO3。A.升高温度常见电离,电离常数增大,A错误;B.加水稀释常见电离,温度不变,电离平衡常数不变,B正确;C.加少量的CH3COONa固体抑制醋酸电离,C错误;D.加少量冰醋酸电离程度减小,D错误,答案选B。(2)甲酸的电离常数大于一水合氨的,因此HCOONH4的水溶液中铵根的水解程度大于甲酸跟,因此溶液呈酸性,HOONH4水解的离子反应方程式为 HCOO-+NH4++H2O![]() HCOOH+NH3·H2O;(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,说明电离程度小于水解程度,因此该溶液中离子的浓度从大到小排列为c(Na+)>c(CN-)>c(OH-)>c(H+)。(4)最终SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中钡离子浓度是1×10-10/0.05mol·L-1=2×10-9mol/L,所以CO32-物质的量浓度=2.6×10-9/2×10-9mol/L=1.3mol·L-1。
HCOOH+NH3·H2O;(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,说明电离程度小于水解程度,因此该溶液中离子的浓度从大到小排列为c(Na+)>c(CN-)>c(OH-)>c(H+)。(4)最终SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中钡离子浓度是1×10-10/0.05mol·L-1=2×10-9mol/L,所以CO32-物质的量浓度=2.6×10-9/2×10-9mol/L=1.3mol·L-1。


科目:高中化学 来源: 题型:
【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。
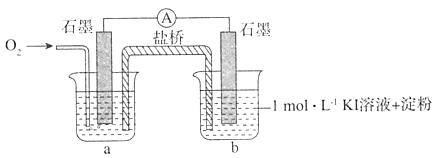
i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 以可逆反应为原理的原电池发生反应达平衡时,该电池仍有电流产生
B. 向AgCl、AgBr的饱和溶液中加入少量的AgNO3,溶液中氯离子和溴离子浓度的比值不变
C. 使用催化剂能够降低反应的△H
D. 金属发生吸氧腐蚀时,被腐蚀的速率和氧浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是_________________。
(2)“平炉”中发生的化学方程式为_________________,该条件下此反应的△S____0(填大于、小于或等于)。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应生成的含锰物质有KMnO4和MnO2,该反应的化学方程式为__________________。
②“电解法”为现代工艺,即电解K2MnO4水溶液,若用惰性电极,阳离子交换膜电解槽电解时产品纯度高,阴极室中加入电解质溶液溶质的化学式为_______,电解时阳极发生的电极反应为____________,从阳极室的溶液得到产品的实验操作是___________________。与传统工艺比较,现代工艺的优点除产品纯度高外还有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )。
A.NaCl晶体中含有Na+、Cl-,所以NaCl晶体能导电
B.CO2溶于水能导电,所以CO2是电解质
C.BaSO4难溶于水, BaSO4是非电解质
D.Cl2的水溶液能够导电,但Cl2既不是电解质也不是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质谱测出,某烃A的相对分子质量为70,回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等的是(填序号)_______。
a.C2H4b.C3H8c.C6H6d.C4H6O
(2)若烃A为链烃,联合红外光谱及其它分析手段,显示该分子含有3个-CH3。
①A的结构简式为__________;
②链烃A与Br2的CCl4溶液反应生成B;B与NaOH的醇溶液共热可得到D,D分子中无溴原子。(提示:碳原子连接两个碳碳双键的结构不稳定)。请写出D的结构简式______;D能发生聚合反应,且聚合产物主链含有碳碳双键,写出D生成E的反应方程式______________。
③B与足量NaOH水溶液完全反应,生成有机物F,该反应的化学方程式为______。
(3)若核磁共振氢谱显示链烃A有四组不同的峰,峰面积比为6::2:1:1,则A的名称为____。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)有像食盐一样的咸味,被称为工业盐。已知:亚硝酸是弱酸,且NO+NO2 +2NaOH=2NaNO2+H2O。某同学据此认为NaNO2可与硫酸反应,且有NO和NO2生成,并欲用下图所示仪器(夹持装置已省略)及药品,验证自己的假设。已知沸点:NO2为21℃,NO为-151℃

(1)上述仪器的连接顺序为:A→____→_____→_____→B。
(2)反应前,先打开弹簧夹,通入一段时间氮气,其目的是____________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生了红棕色气体,
① 依据___________________现象,可确认产物中有NO
② 装置E的作用是_________________。
(4)如果没有装置C,对实验结论的影响是____________________。
(5)综合以上信息推断,NO2与NaOH溶液发生反应的化学方程式为_______________。
(6)己知:2NaNO2+4HI=2NaI+I2+2NO+2H2O,根据这一反应,可以用试剂和生活中的常见物质鉴别亚硝酸钠和食盐,进行实验时,必须选用的物质有__________________。
A.自来水 B.碘化钾溶液 C.淀粉 D.白糖 E. 食醋 F.白酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)溴苯是一种常用的化工原料,通常以苯和溴为原料制取,查资料知:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
在水中的溶解度 | 微溶 | 微溶 | 微溶 |
实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中。
步骤2:充分反应后,向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。

(1)步骤1仪器a中发生的主要化学反应方程式为: 。
(2)仪器c的作用是冷凝回流,回流的主要物质有: 。
(3)步骤3中NaOH所发生的主要反应是: 。
(4)若将图1虚线框部分改为图2装置,则 D、E可以检验出来的物质是 ,其中试管C中苯的作用是 ,能否据此判断发生了取代反应? (填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体Z分别通入起始体积相同的密闭容器Ⅰ(恒容)和Ⅱ(恒压)中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量与时间的变化关系如图所示,则下列有关推断正确的是 ( )

A. 该反应的化学方程式:3X+2Y![]() 3Z
3Z
B. 若两容器中均达到平衡后,体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所用时间小于t0
C. 若两容器中均达到平衡后,且X、Y、Z均为气态,则Z的体积分数Ⅰ>Ⅱ
D. 达平衡后,若对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com