
【题目】高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是_________________。
(2)“平炉”中发生的化学方程式为_________________,该条件下此反应的△S____0(填大于、小于或等于)。
(3)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应生成的含锰物质有KMnO4和MnO2,该反应的化学方程式为__________________。
②“电解法”为现代工艺,即电解K2MnO4水溶液,若用惰性电极,阳离子交换膜电解槽电解时产品纯度高,阴极室中加入电解质溶液溶质的化学式为_______,电解时阳极发生的电极反应为____________,从阳极室的溶液得到产品的实验操作是___________________。与传统工艺比较,现代工艺的优点除产品纯度高外还有_______________。
【答案】 增大接触面积,加快反应速率 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O S>0 3K2MnO4 +4CO2+2H2O=2KMnO4+MnO2+4KHCO3 KOH MnO42- -e- = MnO4- 蒸发浓缩,冷却结晶,过滤 原料利用率大
2K2MnO4+2H2O S>0 3K2MnO4 +4CO2+2H2O=2KMnO4+MnO2+4KHCO3 KOH MnO42- -e- = MnO4- 蒸发浓缩,冷却结晶,过滤 原料利用率大
【解析】(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是增大接触面积加快反应速率,提高原料利用率,故答案为:增大反应物接触面积,加快反应速率;
(2)流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水,反应的化学方程式为:2MnO2+4KOH+O2![]() 2K2MnO4+2H2O,该反应中气体的物质的量增大,△S>0,故答案为:2MnO2+4KOH+O2=2K2MnO4+2H2O;>;
2K2MnO4+2H2O,该反应中气体的物质的量增大,△S>0,故答案为:2MnO2+4KOH+O2=2K2MnO4+2H2O;>;
(3) ①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成KMnO4,MnO2和KHCO3,反应的方程式为3K2MnO4 +4CO2+2H2O=2KMnO4+MnO2+4KHCO3,故答案为:3K2MnO4 +4CO2+2H2O=2KMnO4+MnO2+4KHCO3;
②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-.电极反应式是:MnO42--e-=MnO4-;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e-=H2↑+2OH-;所以阴极逸出的气体是H2;总反应方程式是:2K2MnO4+2H2O![]() 2KMnO4+2H2↑+2KOH,阳离子交换膜电解槽电解时产品纯度高,阴极室中加入电解质溶液溶质的化学式为KOH;从阳极室的溶液得到产品的实验操作为蒸发浓缩,冷却结晶,过滤;依据电解法方程式2K2MnO4+2H2O
2KMnO4+2H2↑+2KOH,阳离子交换膜电解槽电解时产品纯度高,阴极室中加入电解质溶液溶质的化学式为KOH;从阳极室的溶液得到产品的实验操作为蒸发浓缩,冷却结晶,过滤;依据电解法方程式2K2MnO4+2H2O![]() 2KMnO4+2H2↑+2KOH,可知K2MnO4的理论利用率是100%,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中K2MnO4的理论利用率是
2KMnO4+2H2↑+2KOH,可知K2MnO4的理论利用率是100%,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中K2MnO4的理论利用率是![]() ,所以二者的理论利用率之比为3:2,因此与传统工艺比较,现代工艺的优点除产品纯度高外还有原料利用率大,故答案为:KOH ; MnO42- -e- = MnO4- ;蒸发浓缩,冷却结晶,过滤;原料利用率大。
,所以二者的理论利用率之比为3:2,因此与传统工艺比较,现代工艺的优点除产品纯度高外还有原料利用率大,故答案为:KOH ; MnO42- -e- = MnO4- ;蒸发浓缩,冷却结晶,过滤;原料利用率大。


科目:高中化学 来源: 题型:
【题目】据报导,我国已研制出“可充室温钠一二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 充电时碳纳米管接直流电源的正极
C. 放电时每消耗3molCO2,转移12mol电子
D. 充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法正确的是
A. 保持温度不变,向纯水中加入少量CH3COONa,水电离出的c(H+)和c(OH-)乘积不变
B. 25℃向某氨水中加入盐酸使溶液中c(NH4+)=c(Cl-),此时溶液pH=7
C. 将0.1mol/LCH3COOH溶液由20℃升温至30℃,溶液中 减小
减小
D. 保持温度不变,向CH3COONa溶液中加入少量NaOH,溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是

A. 锌片发生还原反应
B. 电子由锌片通过稀硫酸溶液流向铜片
C. 铜片反应式为Cu2+ + 2e- ![]() Cu
Cu
D. 该电池发生的反应是Zn+2H + ![]() Zn2++H2↑
Zn2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物F是合成一种新型降压替米沙坦的中间体,可由下图所示的路线合成:

已知:![]()
请回答下列问题:
(1)A物质名称为________________。
(2)化合物D中所含官能团的名称为_________________。
(3)反应④所需的试剂为_____________。
(4)完成⑤⑥反应的方程式并注明反应类型
①_______________________,反应类型________________。
②_______________________,反应类型_________________。
(5)满足下列条件的C的同分异构体有____种,其中核磁共振氢谱显示4个峰且面积比为3:2:2:1的有_______种。
Ⅰ.含苯环 Ⅱ.含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表1是常温下几种弱酸的电离平衡上述(Ka)和弱碱的电离平衡常数(Kb),表2时常温下几种难(微)溶物的溶度积常数(Kap)
表1 | |
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HIO3 | 1.7×10-1 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3H2O | 1.8×10-5 |
表2 | |
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
请回答下面问题:
(1)上述四种酸中,酸性最强的是______________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)HCOONH4的水溶液呈_______(选填“酸性”、“中性”、“碱性”),写出HCOONH4水解的离子反应方程式____________。
(3)物质的量1:1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为___。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,最终 SO42-物质的量浓度达到0.05mol·L-1,则此时溶液中CO32-物质的量浓度应_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
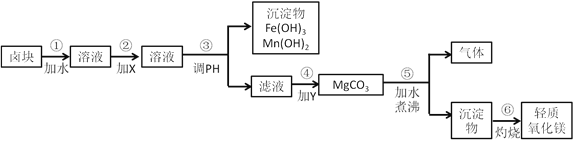
要求产品尽量不含杂质,而且生产成本较低,请根据表中提供的资料,回答下列问题。

(1)在步骤②中加入的试剂X,最佳的选择是______,其作用是__________;
(2)在步骤④中加入的试剂Y是_______________________;
(3)在步骤⑤中发生反应的化学方程式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应8NH3+3Cl2=N2+6NH4Cl,下列说法正确的是( )
A.N2是还原产物
B.Cl2是氧化剂
C.还原剂与氧化剂物质的量之比是3:2
D.还原产物与氧化产物物质的量之比是1 : 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com