
����Ŀ���ݱ������ҹ������Ƴ����ɳ�������һ������̼��ء����缫����Ϊ�ƽ���Ƭ��̼���ܣ����ҺΪ��������һ�ĸʴ������ѣ�����ܷ�ӦΪ��4Na+3CO2![]() 2Na2CO3+C�����ɹ���Na2CO3������̼�����ϡ�������������ȷ����
2Na2CO3+C�����ɹ���Na2CO3������̼�����ϡ�������������ȷ����
A. �ŵ�ʱ�ƽ���Ƭ����������Ӧ
B. ���ʱ̼���ܽ�ֱ����Դ������
C. �ŵ�ʱÿ����3molCO2��ת��12mol����
D. ���ʱ��������ӦΪC+2Na2CO3-4e-=3CO2��+4Na+
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���AM����ͼ��ʾת����ϵ��A��F����������̼ԭ������ͬ���Ҿ����� NaHCO3��Һ��Ӧ��F�ķ���ʽΪC9H10O2,�Ҳ���ʹ���CCl4��Һ��ɫ��D�ܷ���������Ӧ��M��NaOH��Һ��Ӧ��IJ����һ�ȴ���ֻ��һ�֡�

��ش�
��1��B��F�Ľṹ��ʽ�ֱ�Ϊ____________��____________��
��2����Ӧ�����У�������ȥ��Ӧ����________ (�Ӧ���)
��3��D����������Ӧ�Ļ�ѧ����Ϊ_________________________________________��
��Ӧ�ߵĻ�ѧ����Ϊ__________________________________________________��
��4��A����Է���������180260֮�䣬������ת���в���ȷ��A�е�ijһ�����ţ�ȷ���ù����ŵ�ʵ�鲽�������Ϊ________________________________________��
��5����������������F��ͬ���칹�干��________�֡�
a���ܷ���������Ӧ
b������FeCl3��Һ������ɫ��Ӧ
c���˴Ź������������ĸ��壬������֮��Ϊ1:1:2:6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����( )
A��������ռ���ڼ�
B�������ܵ����H+�Ļ����ﶼ������
C����Ƭ�ڿ������ܾ���ȼ�ղ��ų���������
D��NH3��ˮ��Һ���Ե��磬��NH3���ڷǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���Һ������Զ�TiO2���Ⱦ��R���ⷴӦ��Ӱ����ͼ��ʾ�������ж���ȷ���ǣ� ��
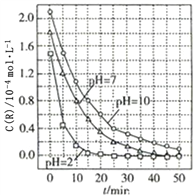
A. ��20��25min֮�䣬pH=10ʱR��ƽ����������Ϊ0.04molL-1min-1
B. ��Һ����Խǿ��R�Ľ�������ԽС
C. R����ʼŨ��ԽС����������Խ��
D. 50minʱ��pH=2��pH=7ʱR�Ľ���ٷ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽ���ǣ� ��
A. �ƺ���ˮ��Ӧ 2Na��2H2O��2Na+��2OH-��H2��
B. ʯ��ʯ�������Һ��Ӧ CaCO3+2H+=Ca2++H2O+CO2��
C. �廯������Һ��ͨ���������� 2Br -+ Cl2=Br2+2C1-
D. NH4HCO3 ��Һ�м��������� NaOH ��Һ��NH4++OH-![]() NH3��+H2O
NH3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԷϾ�п�̵�س���������ѡ���ĺ��̷���(MnO2��MnOOH��MnO������Fe��Pb�ȣ�Ϊԭ���Ʊ��ߴ�MnCl2��xH2O��ʵ���̵��������á��乤���������£�

����a: Mn�Ľ������ǿ��Fe��Mn2+�����������±Ƚ��ȶ���pH����5.5ʱ�ױ�O2������
����b:�����������������pH���±����������ӵ���ʼŨ��Ϊ0.1 mol��L-1)
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
��ʼ����ʱ | 8.1 | 6.5 | 1.9 |
��ȫ����ʱ | 10.1 | 8.5 | 3.2 |
��1������I��Ŀ���ǽ����̡���������Һ1�к��е�������ΪMn2+��Fe3+��Pb2+��H+��
��MnO2��Ũ���ᷴӦ�����ӷ���ʽ��__________________________________��
�ڼ�����Һ1��ֻ��Fe3+����Fe2+�IJ�����������:ȡ������Һ1���Թ��У������ɫK3[Fe(CN)6](���軯��)��Һ�������Ա仯����ȡ������Һ1���Թ��У�___________________________��
��Fe3+��Fe2+ת�����ɣ����ܷ����ķ�Ӧ�У�i.2Fe2++Cl2=2Fe3++2Cl-
ii.4Fe2++O2+4H+=4Fe3++2H2O iii.����
д��iii�����ӷ���ʽ��___________________________��
��2������II��Ŀ���dz��������������ַ�����
i.��ˮ��������Һ1��ϡ�ͣ��ټ�����10%�İ�ˮ�����ˡ�
ii.���շ�������Һ1Ũ���õ��Ĺ�����290��C���գ���ȴ��ȡ����������
��֪�������з�������Ҫ��Ӧ2FeCl3+3O2=2Fe2O3+3Cl2������ʱMnCl2��PbCl2�������仯��
�ٰ�ˮ������ʱ����ҺpHӦ������ _______________֮�䡣
�ڲ�ȫii�еIJ�����____________________��
�����ַ����Ƚϣ���ˮ��������ȱ����_________________________________________��
��3������III��Ŀ���dz�Ǧ��������Լ���______________________��
��4������IV���ù����е�x�IJⶨ���£�ȡm1g��Ʒ�����ڵ�����Χ�м�����ʧȥȫ���ᾧˮʱ��������Ϊm2g����x=________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ��O2������������ҺpH��������������ij��ȤС��̽����ͬ������KI��O2�ķ�Ӧ��ʵ�����¡�
װ�� | �ձ��е�Һ�� | ����5���Ӻ� |
| ��2 mL1 mol/LKI��Һ+5�ε��� | �����Ա仯 |
��2 mL1 mol/LKI��Һ+5�ε���+2 mL0.2 mol/L HCl | ��Һ���� | |
��2 mL1 mol/LKI��Һ+5�ε���+2 mL0.2 mol/L KCl | �����Ա仯 | |
��2 mL1 mol/LKI��Һ+5�ε���+2 mL0.2 mol/L CH3COOH | ��Һ��������ɫ�Ϣ�dz |
��1��ʵ���������I2�����ӷ���ʽ��___________��
��2��ʵ��۵�Ŀ����_________________________________________________________________��
��3��ʵ��ܱȢ���Һ��ɫdz��ԭ����________��
��4��Ϊ��һ��̽��KI��O2�ķ�Ӧ�����ϱ��е�װ�ü�������ʵ�飺
�ձ��е�Һ�� | ����5Сʱ�� |
��2 mLpH=8.5����KOH��1mol/L KI��Һ+5�ε��� | ��Һ���Ա��� |
��2 mLpH=10����KOH��1mol/L KI��Һ+5�ε��� | �����Ա仯 |
I������ʵ�������ͬѧ���������pH=10ʱO2��������I-�������������װ�ý���ʵ�飬��֤���롣
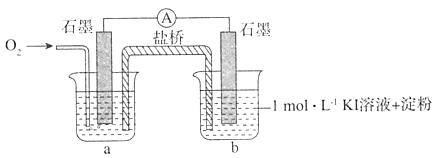
i���ձ�a�е���ҺΪ____��
ii��ʵ�����������˲��벻������֧�ָý��۵�ʵ�������ǣ�ͨ��O2��_______��
������ͬѧ��pH=10��KOH��Һ�������ۣ��еμӵ�ˮ����Һ�ȱ�����Ѹ����ɫ���������ɫ�����Һ�к���IO3-����ɫ��ԭ���ǣ������ӷ���ʽ��ʾ��____________��
��5����С��ͬѧ��ʵ����̽��������巴˼���Ʋ�ʵ��ٵ����������ԭ�������______��ʵ������������ԭ�������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��VL�������к�Na������Ϊm g����
A�� m/23V mol/L B��23/mV mol/L C��2m/23 V mol/L D�� m/46Vmol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(KMnO4)��һ�ֳ�������������Ҫ���ڻ�������������ҩ��ҵ�ȡ������̿�(��Ҫ�ɷ�ΪMnO2)Ϊԭ������������صĹ���·�����£�

�ش��������⣺
(1)ԭ�����̿����������ذ�1��1�ı����ڡ��泴�����л��䣬����ǰӦ�����̿���飬��������_________________��
(2)��ƽ¯���з����Ļ�ѧ����ʽΪ_________________���������´˷�Ӧ�ġ�S____0(����ڡ�С�ڻ����)��
(3)��K2MnO4ת��ΪKMnO4�����������ֹ��ա�
�١�CO2�绯�����Ǵ�ͳ���գ�����K2MnO4��Һ��ͨ��CO2���壬ʹ��ϵ�����Ի������ԣ�K2MnO4�����绯��Ӧ���ɵĺ���������KMnO4��MnO2���÷�Ӧ�Ļ�ѧ����ʽΪ__________________��
�ڡ���ⷨ��Ϊ�ִ����գ������K2MnO4ˮ��Һ�����ö��Ե缫�������ӽ���Ĥ���۵��ʱ��Ʒ���ȸߣ��������м���������Һ���ʵĻ�ѧʽΪ_______�����ʱ���������ĵ缫��ӦΪ____________���������ҵ���Һ�õ���Ʒ��ʵ�������___________________���봫ͳ���ձȽϣ��ִ����յ��ŵ����Ʒ���ȸ����_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com