
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
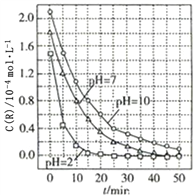
A. 在20~25min之间,pH=10时R的平均降解速率为0.04molL-1min-1
B. 溶液酸性越强,R的降解速率越小
C. R的起始浓度越小,降解速率越大
D. 50min时,pH=2和pH=7时R的降解百分率相等
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。实验室用氯化钠、废铁屑、稀硫酸、氢氧化钾溶液等为原料,通过以下过程制备高铁酸钾(K2FeO4):

(l) Na2O2的电子式为__________。
(2)操作I的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、隔绝空气减压干燥.其中隔绝空气减压干燥的目的是_______。
(3)气体X为____,写出FeSO4与Na2O2反应的化学方程式:________。
(4)最终在溶液中可得到K2FeO4 晶体的原理是_________。
(5)已知K2FeO4在水溶液中可以发生:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑,,则K2FeO4 可以在水处理中的作用是__________。
4Fe(OH)3(胶体)+8OH-+3O2↑,,则K2FeO4 可以在水处理中的作用是__________。
(6)称取提纯后的K2FeO4样品0.2100g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250mL 溶液,取出25.00 mL放入锥形瓶,用0.0l000mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00mL。涉及的主要反应为:Cr(OH)4-+FeO42-=Fe(OH)3+CrO42-+OH-
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是( )
A.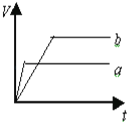 B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )。
A.同温同压下,相同体积的物质,其物质的量一定相等
B.标准状况下,等物质的量的甲烷和一氧化碳所含的原子数一定相等
C.1 L一氧化碳气体一定比1 L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报导,我国已研制出“可充室温钠一二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2![]() 2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
2Na2CO3+C,生成固体Na2CO3沉积在碳纳米管上。下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 充电时碳纳米管接直流电源的正极
C. 放电时每消耗3molCO2,转移12mol电子
D. 充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的说法正确的是
A. 保持温度不变,向纯水中加入少量CH3COONa,水电离出的c(H+)和c(OH-)乘积不变
B. 25℃向某氨水中加入盐酸使溶液中c(NH4+)=c(Cl-),此时溶液pH=7
C. 将0.1mol/LCH3COOH溶液由20℃升温至30℃,溶液中 减小
减小
D. 保持温度不变,向CH3COONa溶液中加入少量NaOH,溶液中 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com