
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。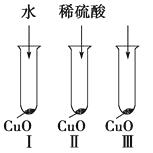
(1)该同学提出的假设是。
(2)通过实验Ⅰ可以证明。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认实验为:在Ⅲ中先加入溶液,再加入溶液。
(4)探究结果为。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是。
【答案】
(1)H2O、H+、SO42-中的某一种粒子能够使CuO溶解
(2)水不能使氧化铜溶解,而是H+、SO42-两种粒子中的一种使CuO溶解
(3)Na2SO4(或K2SO4等);稀盐酸
(4)氧化铜固体溶于稀H2SO4 , 是稀硫酸中H+在起作用,而H2O、SO42-两种粒子都不能使CuO溶解;稀硝酸(或稀盐酸等)
【解析】(2)水与CuO不反应,则与CuO反应的只能是H+、SO42-中的一种;(3)要验证是H+还是SO42-能与CuO反应,在选择试剂时,最好一种含SO42-而不含H+ , 另一种含H+而不含SO42-;(4)结果显然应该是H+使CuO溶解,而不是H2O或SO42-。利用所学知识可以判断稀盐酸、稀硝酸等可以使CuO溶解。


科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
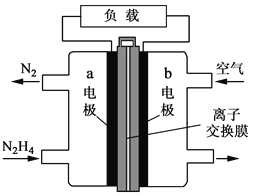
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
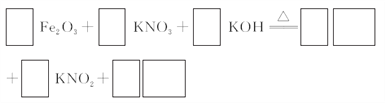
【题目】铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+生成Fe3+的离子方程式___________________。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共熔制得高铁酸钾的化学方程式,并配平:___________
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1 00 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①写出滴定选用的指示剂________,滴定终点观察到的现象_______________________。
②溶液Ⅰ中铁元素的总含量为__________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。 
(1)比较两实验装置,图2所示装置的优点是: ①能更好地吸收有毒气体SO2 , 防止其污染环境;
②。
(2)能说明有SO2气体产生的实验现象是?
(3)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能: Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空白:
A.稀盐酸溶液 B.稀硫酸溶液
C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉KI溶液
G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的 , 根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号),溶液的颜色变色则试样中含有Fe3+ , 发生反应的离子方程式为。
步骤2.再取适量的试样滴加到少量的(填试剂序号),溶液的颜色变为色,则试样中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有流失的生产用料、中间产物和产品,以及生产过程中产生的污染物.随着工业的迅速发展,废水的排放量迅速增加,严重威胁人类的健康和安全,工业废水的处理比城市污水的处理更为重要.图是含铬工业废水和含氰废水的处理流程: 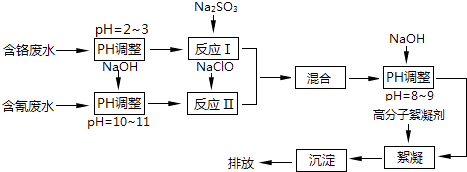
请回答下列问题:
(1)电镀废水中的铬主要以CrO42﹣形式存在,其中Cr元素的化合价为 .
(2)酸性条件下,CrO42﹣极易被还原剂还原为毒性较小的Cr3+ . 图中“反应Ⅰ”的离子方程式为 .
(3)pH>10时,“反应Ⅱ”中的NaClO可快速地将氰离子(CN﹣)氧化为无毒的两种物质,这两种物质是、(写化学式);若pH<8.5,则生成剧毒的CNCl气体(沸点13.1℃),写出该反应的离子方程式 .
(4)经过“反应Ⅰ”和“反应Ⅱ”将两种废水混合的目的是 .
(5)含氰废水及含铬废水可以通过电化学的方法进行无害化处理. ①可采用惰性电极对含氰废水进行电解,氰离子在碱性条件下被氧化为无毒的物质,该电解工艺中,阳极电极反应是 .
②电解法处理酸性含铬废水(若铬元素以Cr2O72﹣形式存在)时,以铁板和石墨作电极,处理过程中存在反应Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O.则阳极的电极反应式为 , 当有1mol Cr2O72﹣被还原时,电路中转移的电子为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证: 猜想Ⅰ:甲酸具有酸性
实验Ⅰ:在甲酸溶液中滴加紫色石蕊试液
猜想Ⅱ:甲酸能发生酯化反应
实验Ⅱ:[装置如图(1)所示]
猜想Ⅲ:甲酸能发生银镜反应
实验Ⅲ:[步骤如图(2)所示]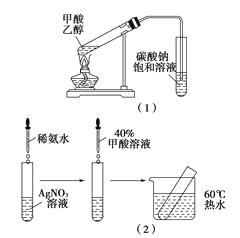
(1)问题Ⅰ:请你进一步设计实验证明甲酸是强酸还是弱酸?
(2)问题Ⅱ:实验Ⅱ能验证猜想Ⅱ吗?;如能,请说明你的理由;如不能,请指出实验Ⅱ中的错误。
(3)问题Ⅲ:分析甲酸的结构,实验Ⅲ中没有出现任何现象的可能原因是。
(4)问题Ⅳ:请你在仔细分析甲酸的组成和结构的基础上,再提出一个关于甲酸性质的猜想并设计实验方案验证你的猜想: ①你提出的猜想是。
②你设计的实验方案是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①2Fe2++Br2=2Fe3++2Br- ②2Br-+Cl2=Br2+2Cl- ③2Fe3++2I-=2Fe2++I2。由此判断下列说法正确的是
A. 铁元素在反应①中被还原,在③中被氧化
B. 反应②中当有1molCl2被还原时,有1mol电子转移
C. 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+
D. 还原性强弱顺序为:I->Fe2+>Br->Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com