
【题目】常温下,在溶液中可发生以下反应:
①2Fe2++Br2=2Fe3++2Br- ②2Br-+Cl2=Br2+2Cl- ③2Fe3++2I-=2Fe2++I2。由此判断下列说法正确的是
A. 铁元素在反应①中被还原,在③中被氧化
B. 反应②中当有1molCl2被还原时,有1mol电子转移
C. 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+
D. 还原性强弱顺序为:I->Fe2+>Br->Cl-
【答案】D
【解析】A,反应①中Fe元素的化合价由+2价升至+3价,反应①中Fe元素被氧化,反应③中Fe元素的化合价由+3价降至+2价,反应③中Fe元素被还原,A项错误;B,反应②中Cl元素的化合价由0价降至-1价,1molCl2被还原时,有2mol电子转移,B项错误;C,根据同一反应中氧化性:氧化剂![]() 氧化产物,由反应①得出氧化性:Br2
氧化产物,由反应①得出氧化性:Br2![]() Fe3+,由反应②得出氧化性:Cl2
Fe3+,由反应②得出氧化性:Cl2![]() Br2,由反应③得出氧化性:Fe3+
Br2,由反应③得出氧化性:Fe3+![]() I2,氧化性由强到弱的顺序为:Cl2
I2,氧化性由强到弱的顺序为:Cl2![]() Br2
Br2![]() Fe3+
Fe3+![]() I2,C项错误;D,根据同一反应中还原性:还原剂
I2,C项错误;D,根据同一反应中还原性:还原剂![]() 还原产物,由反应①得出还原性:Fe2+
还原产物,由反应①得出还原性:Fe2+![]() Br-,由反应②得出还原性:Br-
Br-,由反应②得出还原性:Br-![]() Cl-,由反应③得出还原性:I-
Cl-,由反应③得出还原性:I-![]() Fe2+,还原性由强到弱的顺序为:I-
Fe2+,还原性由强到弱的顺序为:I-![]() Fe2+
Fe2+![]() Br-
Br-![]() Cl-,D项正确;答案选D。
Cl-,D项正确;答案选D。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质.处理C物质可得到有价值的化学品,写出其中1种酸和1种盐的名称 .
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.B与C在一定条件下反应生成的A是大气主要成分,写出该反应的化学方程式 .
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.判断单质A的元素在周期表中的位置是 .写④反应离子方程式 .
(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式 .D的化学式是 .
(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式 .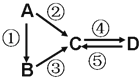
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过图Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。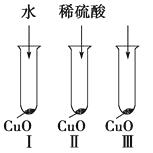
(1)该同学提出的假设是。
(2)通过实验Ⅰ可以证明。
(3)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步所做的确认实验为:在Ⅲ中先加入溶液,再加入溶液。
(4)探究结果为。你认为除实验Ⅱ和Ⅲ所用的试剂外,还能溶解氧化铜的一种常见物质是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.标准状况下,1 mol水占的体积是22.4 LB.1 mol H+的质量是1 g
C.1 L 1 mol/L盐酸溶液中,有1molHCl分子D.二氧化硫的摩尔质量是64 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的说法中,正确的是
A. 热稳定性:Na2CO3< NaHCO3
B. Na2CO3粉末中混有NaHCO3时可用加热的方法除去
C. 用氢氧化钙溶液鉴别Na2CO3和NaHCO3两种溶液
D. Na2CO3溶液和NaHCO3,溶液分别加入CaCl2溶液,都产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图,实验桌上放置的两容器中有等体积的甲、乙两种液体。几天后,两者的体积都明显减少,且甲比乙减少得多。由此现象得出的正确结论是( )
甲 乙
A.甲比乙易挥发
B.甲的沸点比乙高
C.甲的熔点比乙小
D.甲与乙都能挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
A.28g乙烯所含共用电子对数目为4NA
B.0.5mol 1,3﹣丁二烯分子中含有C=C双键数为NA
C.1 mol羟基所含的电子总数为10NA
D.标准状况下,11.2 L己烷所含分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质监局人员监测市场出售的老陈醋的酸度(国家规定食醋中总酸量3.5g/100mL~5g/100mL),需配制一定质量分数的氢氧化钠溶液,然后用氢氧化钠溶液进行食醋中酸量测定.请回答相关问题.
(1)用氢氧化钠和水配制200g质量分数为10%的氢氧化钠溶液需要水mL(水的密度为1g/cm3).
(2)若陈醋中的酸均看成是醋酸,醋酸与氢氧化钠反应的方程式如下:CH3COOH+NaOH=CH3COONa+H2O,现有每瓶500mL的老陈醋,从中取出10mL加入指示剂,共滴入10%的氢氧化钠溶液2.4g,恰好完全反应.请通过计算判断该食醋是否合格?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com