
下列物质的用途正确的是
可以用Na2O2漂白食品,而不能用SO2于干果防腐
B.用石英制太阳能电池
C. 食醋可去除水垢,NH4Cl溶液可去除铁锈
D.用电解熔融氯化铝的方法制得单质铝
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液
B.催化剂可以加快化学反应速率但不能改变化学反应的焓变
C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱
D.对于反应2SO2(g)+O2(g)  2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒半径大小比较正确的是:
A.Na+<Mg2+<Al3+<O2- B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S D.Ca<Rb<K<Na
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.14 g乙烯和丙烯的混合物中总原子数为3NA
B.常温下11.2 L甲烷气体含有甲烷分子数为0.5NA
C.5.6 g铁与足量的稀硫酸反应失去电子数为0.3 NA
D.0.1 mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为____________________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
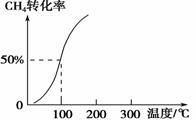 ①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
(4) 写出甲醇-空气-KOH溶液的燃料电池负极的电极反应式:______________________。
 (5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式________。
②写出除去甲醇的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各种溶液中,能大量共存的无色透明的离子组
A.PH=0的溶液:CH3COO- 、NO3-、SO42-、I-
B.C(H+)=10-14mol/L的溶液中:Na+ 、AlO2-、S2-、SO32-
C.酸性环境下:Na+、Cu2+、NO3-、SO42-、
D.pH=7的溶液中:K+ 、Na+ 、Fe3+ 、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol,
则甲烷的燃烧热为Q kJ/mol
B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的
ΔH<0
C.反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反
2NH3(g)ΔH<0达到平衡后,升高温度,反
应速率v(H2)和H2的平衡转化率均增大
D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值
均大于零):
H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol
H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.在水中能电离出离子的化合物一定是离子化合物
B.CO2分子中含极性键,且溶于水能导电,所以CO2是电解质
C.Ca(OH)2微溶于水,所以是弱电解质
D.CH3COOH在水中只能部分电离,所以是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com