
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
下列物质的用途正确的是
可以用Na2O2漂白食品,而不能用SO2于干果防腐
B.用石英制太阳能电池
C. 食醋可去除水垢,NH4Cl溶液可去除铁锈
D.用电解熔融氯化铝的方法制得单质铝
查看答案和解析>>
科目:高中化学 来源: 题型:
LiFePO4新型锂离子动力电池是绿色能源的新宠。已知该电池放电时的电极反应式为:正极 FePO4+Li++e-==LiFePO4 ,负极 Li-e-== Li+下列说法中正确的是
A.充电时电池反应为FePO4+Li = LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向正极移动
D.放电时,在正极上是Li+得电子被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
参照反应Br+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是
A.反应物具有的总能量大于生成物具有的总能量
B.正反应为吸热反应
C.该反应的逆反应是吸热过程
D.图中可以看出,HBr的能量一定高于H2的能量

查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
 (1)此反应的化学方程式中
(1)此反应的化学方程式中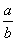 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
(3)平衡时,N的转化率为 。
(4)下列叙述中能说明上述反应达到平衡状态的是
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法中正确的是 ( )。
A.等物质的量的CO2和NH3中所含的分子数均为NA
B.标准状况下,33.6 L SO3中含有的氧原子数是4.5NA
C.常温下,34.5 g NO2与N2O4的混合物中含有1.5NA个氧原子
D.电解精炼铜时,每转移2NA个电子,阳极溶解64 g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的数值。下列有关叙述正确的是 ( )。
A.标准状况下,2.24 L庚烷含有的分子数等于0.1 NA
B.常温下,100 mL 1 mol·L-1 Na2CO3溶液中阴离子总数为0.1 NA
C.分子数为NA的CO、C2H4的混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N—H键数目为0.6  NA
NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=1的溶液中,能大量共存的一组离子或分子是 ( )。
A.Mg2+、Na+、ClO-、NO3-
B.Al3+、NH4+、Br-、Cl-
C.K+、Cr2O72-、CH3CHO、SO42-
D.Na+、K+、SiO32-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计除去污水中的金属离子,并回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】 NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
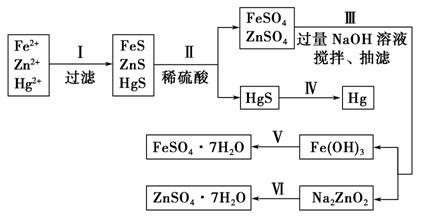
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________。
(2)步骤Ⅲ中抽滤的目的是____________,该步骤产生Fe(OH)3的反应的离子方程式为_________________ _____________________________________。
_____________________________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子方程式为___________________________ _____________________________________________________________。
(4)欲实现步骤Ⅴ,需加入的试剂有________、________,所涉及的主要操作依次为__________________________________________________________。
(5)步骤Ⅳ常用的方法是________,该步骤是否对环境有影响?________(填“是”或“否 ”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应:_____________________________________________________________。
”),如有影响,请你设计一个绿色环保方案来实现步骤Ⅳ的反应:_____________________________________________________________。
(6)该研究小组的同学在强碱溶液中,用次氯酸钠与Fe(OH)3反应获得了高效净水剂Na2FeO4,该反应的离子方程式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com