
参照反应Br+H2→HBr+H的能量随反应历程变化的示意图,下列叙述中正确的是
A.反应物具有的总能量大于生成物具有的总能量
B.正反应为吸热反应
C.该反应的逆反应是吸热过程
D.图中可以看出,HBr的能量一定高于H2的能量

 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.14 g乙烯和丙烯的混合物中总原子数为3NA
B.常温下11.2 L甲烷气体含有甲烷分子数为0.5NA
C.5.6 g铁与足量的稀硫酸反应失去电子数为0.3 NA
D.0.1 mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.在水中能电离出离子的化合物一定是离子化合物
B.CO2分子中含极性键,且溶于水能导电,所以CO2是电解质
C.Ca(OH)2微溶于水,所以是弱电解质
D.CH3COOH在水中只能部分电离,所以是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题
(1)甲同学运用沉淀法测定样品中NaOH的含量。甲同学选用的药品除样品外,还应有
▲ ,实验中应测定的数据有 ▲ 。
(2)乙同学运用滴定法测定样品中NaOH的含量。
①用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 ▲ 。滴定终点的现象是 ▲ 。
②下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 ▲ (填写序号)
 A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
③若滴定开始和结束时,酸式滴定管中的液面如右图所示:
开始 结束
则起始读数为 ▲ mL,终点读数 ▲ mL;
(3)某学生根据三次实验分别记录有关数据如下:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 第一次 | 20.00 | 0.00 | 26.01 | |
| 第二次 | 20.00 | 1.56 | 30.30 | |
| 第三次 | 20.00 | 0.22 | 26.21 |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排列顺序不正确的是
A.热稳定性:HF>HCl>HBr B.原子半径:Na>S>O
C.离子半径: Mg2+>O2->F- D.酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
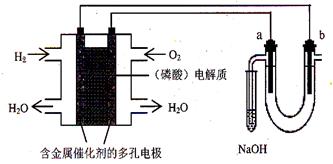
用酸性氢氧燃料电池电解饱和食盐水的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH-B.电解时,a 电极周围首先放电的是Cl—
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.2g H2 时,b极周围会产生2.24L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1,计算:
(1)前2 min内用X的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )。
A.标准状况下,将22.4 L氯化氢溶于足量水中,溶液中含有的HCl分子数
为NA
B.常温常压下,16 g 14CH4所含中子数目为8NA
C.常温常压下,7.1 g Cl2与足量NaOH溶液反应,转移电子的数目为0.1 NA
D.标准状况下,22.4 L空气含有NA个单质分子
查看答案和解析>>
科目:高中化学 来源: 题型:
工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
 |
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
 Na2CO3·10H2O Na2CO3·7H2O Na2CO3·H2O
Na2CO3·10H2O Na2CO3·7H2O Na2CO3·H2O
32 36 t(℃)
回答下列问题:
(1)溶解时通入热空气的作用有 (写出两条即可);生成氢氧化镁沉淀的离子方程式为 。
(2)“趁热过滤”时的温度应控制在 ;简述过滤后洗涤固体的操作 。
(3)为检验母液中是否含有Cl-,必须加入的试剂为 。
(4)实验室进行“灼烧”的陶瓷仪器有 。
 (5)室温下用石墨电极电解饱和Na2CO3溶液(装置如图),写出Y电极
(5)室温下用石墨电极电解饱和Na2CO3溶液(装置如图),写出Y电极
反应式: ;一段时间后X电极可收集到的
气体一定有 ,可能有 。
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com