
【题目】常温下,向10mL0.1 mol/L CuCl2溶液中滴加0.1 mol/L Na2S溶液滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )

A. 该温度下Ksp(CuS)=10-35.4
B. 曲线上各点的溶液均满足关系式c(S2-)·c(Cu2+)=Ksp(CuS)
C. Na2S溶液中C(S2-)+C(HS-)+C(H2S)=2C(Na+)
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
【答案】C
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-![]() CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中的守恒思想,据此判断分析。
CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中的守恒思想,据此判断分析。
A.b点是CuCl2溶液与Na2S溶液恰好完全的点,该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,故A正确;
B.向含有Cu2+的溶液中加入Na2S溶液,Cu2+与S2-发生沉淀反应:Cu2++S2-![]() CuS↓,加入Na2S溶液的体积越大,c(S2-)越大,c(Cu2+)越小,则-lg c(Cu2+)就越大,由于温度不变,所以曲线上各点的溶液均满足关系式:c(S2-)·c(Cu2+)=Ksp(CuS),故B正确;
CuS↓,加入Na2S溶液的体积越大,c(S2-)越大,c(Cu2+)越小,则-lg c(Cu2+)就越大,由于温度不变,所以曲线上各点的溶液均满足关系式:c(S2-)·c(Cu2+)=Ksp(CuS),故B正确;
C.Na2S溶液中,根据物料守恒,2c(S2-)+2c(HS-)+2c(H2S)═c(Na+),故C错误;
D.c点为Na2S、NaCl按1:2物质的量混合溶液,其中CuS处于沉淀溶解平衡状态,根据物料守恒及物质的溶解性可知:c(Na+)>c(Cl-)>c(S2-),S2-水解消耗水电离产生H+,使溶液中c(OH-)>c(H+),但水电离产生的离子浓度远小于盐电离产生的离子浓度,故c(S2-)>c(OH-),因此该溶液中微粒浓度大小关系为:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+),故D正确。
故选C。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:
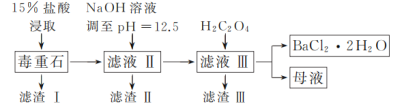
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用丁烷催化脱氢侧备丁烯:C4H10(g)![]() CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
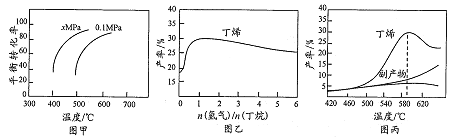
A. 由图甲可知,x小于0.1
B. 由图乙可知,丁烯产率先增大后减小,减小的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速 率减小
C. 由图丙可知产率在590℃之前随温度升高面增大的原因可能是溫度升高平衡正向移动
D. 由图丙可知,丁烯产率在590℃之后快速降低的主要原因为丁烯高温分解生成副产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是

A. 质子透过阳离子交换膜由右向左移动
B. 电子流动方向为N→Y→X→M
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )

A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2
B.与途径①、③相比,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应原理在工业的应用:
(1)科研人员将粗锰(含杂质的锰)粉碎后加入到SnCl2溶液中使其溶解浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s),为加快反应速率可以采取的措施________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
Mn2+(aq)+ Sn(s),为加快反应速率可以采取的措施________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
(2)常温下,Ksp(FeS)=1×10-18,FeS饱和溶液中[H+]与[S2-]之间存在关系:[H+]2·[S2-]=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的PH=_______。
(3)工业上利用含镍废水(镍主要以NiR2络合物形式存在制取草酸镍(NiC2O4),工艺流程如图所示:

已知:Ⅰ:NiR2(aq)![]() Ni2+(aq)+2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq)+2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ⅱ:Ksp[Fe(OH)3]=1×10-38,Ksp[Ni(OH)2]=2×10-15
Ⅲ:“脱络”过程中,R-能与·OH(Fe2+和H2O2反应产生的中间产物)反应生成·R(有机物自由基)
①“沉铁”时,若溶液中c(Ni2+)=0.01mol·L-1,加入碳酸钠调溶液的pH=________(假设溶液体积不变)使Fe3+恰好沉淀完全(离子的浓度≤1.0×10-5mol·L-1),此时________(填“有”或“无”)Ni(OH)2沉淀生成。
②“沉镍”即得到草酸镍沉淀,其离子方程式是______________________
③NiR2中加入Fe2+和H2O2能够实现“脱络”的原因是_________________
(4)Na2SO3氧化反应:2Na2SO3+O2=2Na2SO4其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。为确定贫氧区速率方程![]() 中a的值(取整数),分析实验数据。当溶解氧浓度为4. 0 mg·L-1时,c(Na2SO3)与速率数值关系如下表,则a=______。
中a的值(取整数),分析实验数据。当溶解氧浓度为4. 0 mg·L-1时,c(Na2SO3)与速率数值关系如下表,则a=______。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
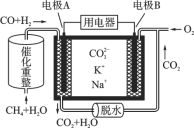
A. 反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4 转移2 mol 电子
3H2+CO,每消耗1 mol CH4 转移2 mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-===2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一种由天然MnO2矿与MnS矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
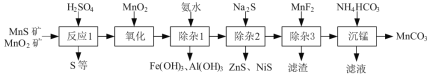
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
⑴“反应1”中MnO2与MnS反应的化学方程式为______。
⑵“反应1”后所得沉淀物中除S外,一定还含有的氧化物是______(填化学式)。
⑶“除杂2”后溶液中c(Zn2+)=1×105 mol·L1,则溶液中c(Ni2+)=______mol·L1。[已知:Ksp(ZnS)=2×1022,Ksp(NiS)=1×1024]
⑷“滤渣”的成分为______(填化学式);“滤液”中所含溶质的主要成分为___(填化学式)。
⑸将部分MnCO3溶于稀硫酸,所得溶液电解可制得MnO2循环使用。写出电解时所发生反应的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.做中和热测定实验时,在大小烧杯之间填满碎泡沫塑料以防止热量散失
B.海上石油钢铁钻井平台可用外加电流的阴极保护法以防腐
C.H2O2催化分解每产生1molO2,转移电子的数目为2×6.02×1023
D.25℃时,加水稀释0.1molL﹣1NH4Cl,溶液中![]() 不断增大
不断增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com