
【题目】反应原理在工业的应用:
(1)科研人员将粗锰(含杂质的锰)粉碎后加入到SnCl2溶液中使其溶解浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s),为加快反应速率可以采取的措施________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
Mn2+(aq)+ Sn(s),为加快反应速率可以采取的措施________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
(2)常温下,Ksp(FeS)=1×10-18,FeS饱和溶液中[H+]与[S2-]之间存在关系:[H+]2·[S2-]=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的PH=_______。
(3)工业上利用含镍废水(镍主要以NiR2络合物形式存在制取草酸镍(NiC2O4),工艺流程如图所示:

已知:Ⅰ:NiR2(aq)![]() Ni2+(aq)+2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq)+2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ⅱ:Ksp[Fe(OH)3]=1×10-38,Ksp[Ni(OH)2]=2×10-15
Ⅲ:“脱络”过程中,R-能与·OH(Fe2+和H2O2反应产生的中间产物)反应生成·R(有机物自由基)
①“沉铁”时,若溶液中c(Ni2+)=0.01mol·L-1,加入碳酸钠调溶液的pH=________(假设溶液体积不变)使Fe3+恰好沉淀完全(离子的浓度≤1.0×10-5mol·L-1),此时________(填“有”或“无”)Ni(OH)2沉淀生成。
②“沉镍”即得到草酸镍沉淀,其离子方程式是______________________
③NiR2中加入Fe2+和H2O2能够实现“脱络”的原因是_________________
(4)Na2SO3氧化反应:2Na2SO3+O2=2Na2SO4其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。为确定贫氧区速率方程![]() 中a的值(取整数),分析实验数据。当溶解氧浓度为4. 0 mg·L-1时,c(Na2SO3)与速率数值关系如下表,则a=______。
中a的值(取整数),分析实验数据。当溶解氧浓度为4. 0 mg·L-1时,c(Na2SO3)与速率数值关系如下表,则a=______。
![]()
【答案】升高温度或增大c(Sn2+) 构成原电池 2 3 无 Ni2++H2C2O4 =NiC2O4↓ +2H+ R-能与OH反应使NiR2(aq)![]() Ni2+(aq)+2R-(aq)中R-浓度减小,平衡向正向移动,实现“脱络” 2
Ni2+(aq)+2R-(aq)中R-浓度减小,平衡向正向移动,实现“脱络” 2
【解析】
(1)为加快反应速率可以适当升高温度、增大c(Sn2+)等,根据反应方程式,有Sn单质的生成,与Mn构成原电池,加快反应速率,故答案为:升高温度或增大c(Sn2+),构成原电池。
(2)由于c(Fe2+)=1mol·L-1,c(S2-)=![]() =
=![]() =1×10-18,又由于[H+]2·[S2-]=1.0×10-22,所以c(H+)=1×10-2mol/L,所以应调节溶液中的pH=2,故答案为:2。
=1×10-18,又由于[H+]2·[S2-]=1.0×10-22,所以c(H+)=1×10-2mol/L,所以应调节溶液中的pH=2,故答案为:2。
(3)①Ksp[Fe(OH)3]=1×10-38,则使Fe3+恰好沉淀完全所需的c(OH-)=![]() =1×10-11mol/L,此时溶液的pH=-lgc(H+)=
=1×10-11mol/L,此时溶液的pH=-lgc(H+)=![]() =3,因溶液中c(Ni2+)=0.01mol·L-1,则c(Ni2+)×c2(OH-)=0.01×(1×10-11)2=1×10-24<Ksp[Ni(OH)2],因此无Ni(OH)2沉淀生成,故答案为:3,无。
=3,因溶液中c(Ni2+)=0.01mol·L-1,则c(Ni2+)×c2(OH-)=0.01×(1×10-11)2=1×10-24<Ksp[Ni(OH)2],因此无Ni(OH)2沉淀生成,故答案为:3,无。
②“沉镍”过程中加入草酸得到草酸镍沉淀,其离子方程式是Ni2++H2C2O4 =NiC2O4↓ +2H+,故答案为:Ni2++H2C2O4 =NiC2O4↓ +2H+。
③络合物NiR2在溶液中存在以下平衡:NiR2(aq)![]() Ni2+(aq)+2R-(aq)。Fe2+与H2O2反应生成—OH,—OH与R-反应转化为难以与Ni2+络合的—R,使溶液中c(R-)减小,平衡正向移动,实现“脱络”,故答案为:R-能与OH反应使NiR2(aq)
Ni2+(aq)+2R-(aq)。Fe2+与H2O2反应生成—OH,—OH与R-反应转化为难以与Ni2+络合的—R,使溶液中c(R-)减小,平衡正向移动,实现“脱络”,故答案为:R-能与OH反应使NiR2(aq)![]() Ni2+(aq)+2R-(aq)中R-浓度减小,平衡向正向移动,实现“脱络”。
Ni2+(aq)+2R-(aq)中R-浓度减小,平衡向正向移动,实现“脱络”。
(4)当溶解氧浓度为4.0mgL-1时,c(Na2SO3)与速率数值关系如表,v1:v2=c1a(SO32-):c2a(SO32-),![]() =
=![]() ,解得a=2;故答案为:2。
,解得a=2;故答案为:2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】过渡元素形成的化合物在生产中有重要的用途,请根据信息回答下列问题:
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于____(填“晶体”或“非晶体”)。
(2)黄铜是最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)___Ⅰ1(Cu)(填“>”或“<”) ,原因是____。
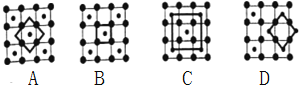
(3)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子),图中用粗线画出的重复结构单元示意图,其中不能描述CoO2的化学组成的是____(填字母)。
(4)在稀氨水中,丁二酮肟(CH3C=N-OH)2与Ni2+反应可生成鲜红色沉淀丁二酮肟镍(结构如图)和H+,常用于检验Ni2+。在丁二酮肟镍中,不存在的作用力有____。
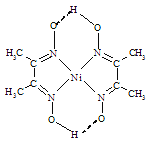
A 配位键 B 离子键 C σ键 D π键 E 金属键 F 氢键
(5)Co3+ 的一种配离子[Co(N3) (NH3)5]2+中,配体有_____,1mol该配离子中所含σ键的数目______。
(6)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____,该立方体中Fe2+间连接起来形成的空间构型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)。回答下列问题:
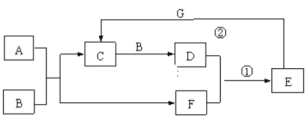
⑴A的电子式为__________。
⑵反应①的化学方程式为_______,该反应的氧化剂和还原剂的物质的量之比为________;
⑶反应②的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁-锂双离子二次电池如图,下列关于该电池的说法不正确的是

A. 放电时,Li+由左向右移动
B. 放电时,正极的电极反应式为Li1-xFePO4+xLi++xe-= LiFePO4
C. 充电时,外加电源的正极与Y相连
D. 充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1 mol/L CuCl2溶液中滴加0.1 mol/L Na2S溶液滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )

A. 该温度下Ksp(CuS)=10-35.4
B. 曲线上各点的溶液均满足关系式c(S2-)·c(Cu2+)=Ksp(CuS)
C. Na2S溶液中C(S2-)+C(HS-)+C(H2S)=2C(Na+)
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和 W在元素周期表中的位置如下图所示, 其最外层电子数之和为21。下列说法中正确的是
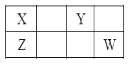
A. 单质W可由海水作原料获得
B. Y 的非金属性比 X的强,所以Y的氢化物一定比 X的更稳定
C. 工业上常利用单质 X与含 Z氧化物的矿石在高温下反应制备高纯 Z
D. X的氢化物可以与 W的单质发生反应,但是不能与 W 的氢化物发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末 X 中可能含有 Fe2O3、CuO、MnO2、CaO、NaCl 和 K2CO3 中的若干种。为确定该固体粉末的成分,进行了以下实验(所加试剂均过量):
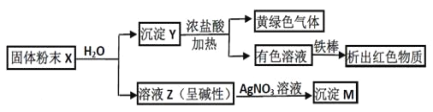
下列结论正确的是:
A. 固体粉末中一定含 K2CO3B. X 中可能存在 Fe2O3
C. 沉淀 M 一定含 AgClD. 沉淀 Y 中不一定存在 MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不能正确表示某沉淀溶解过程的是
A.热的浓盐酸洗涤试管内壁的MnO2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.热的NaOH溶液洗涤试管内壁的S:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
C.向石灰石粉的悬浊液中持续通CO2:Ca(OH)2+2CO2=Ca(HCO3)2
D.稀硫酸可除去铁锈:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com